
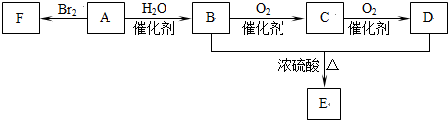
分析 A的产量通常衡量一个国家的石油化工水平,则A应为CH2=CH2,与溴单质发生加成反应生成1,2-二溴乙烷,CH2=CH2与水在一定条件下发生加成反应生成CH3CH2OH,所以B是乙醇,乙醇在Cu或Ag作催化剂条件下发生氧化反应生成C,C结构简式为CH3CHO,CH3CHO可进一步氧化物CH3COOH,则D结构简式为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成E为CH3COOCH2CH3,以此解答该题.
(1)卤代烃在碱性水溶液加热条件下发生取代反应,卤代烃中的卤素原子被羟基取代;
(2)A生成B:碳碳双键可发生加成反应,与水反应生成醇;B生成C:醇在Cu或Ag作催化剂条件下发生氧化反应;
(3)B是乙醇,根据乙醇被氧化生成具有刺激性气味的乙醛分析;
解答 解:A的产量通常衡量一个国家的石油化工水平,则A应为CH2=CH2,与溴单质发生加成反应:CH2=CH2+Br2→CH2BrCH2Br,生成1,2-二溴乙烷,CH2=CH2与水在一定条件下发生加成反应CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH,所以B是乙醇,乙醇在Cu或Ag作催化剂条件下发生氧化反应2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O生成C,C结构简式为CH3CHO,CH3CHO可进一步氧化2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH,则D结构简式为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O,E为CH3COOCH2CH3,
CH3COOCH2CH3+H2O,E为CH3COOCH2CH3,
(1)卤代烃在碱性水溶液加热条件下发生取代反应,由1,2-二溴乙烷变成乙二醇,生成乙二醇与溴化钠方程式为:CH2BrCH2Br+2NaOH$→_{△}^{H_{2}O}$CH2OHCH2OH+2NaBr,
故答案为:氢氧化钠的水溶液;
(2)A生成B:CH2=CH2与水在一定条件下发生加成反应CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH,B生成C:醇羟基和醇羟基相连的碳分别脱氢生成醛,2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O
故答案为:CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH;2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O;
(3)B是乙醇,铜丝放在酒精灯外焰部分加热,铜被氧气氧化为黑色氧化铜,立即将它插入盛乙醇的试管,氧化铜能将乙醇氧化为乙醛,同时由黑色氧化铜又变成红色铜,试管中有刺激性气味的乙醛生成,
故答案为:铜丝表面由黑变红,有刺激性气味产生.
点评 本题考查有机物推断,为高频考点,把握官能团与性质的关系、掌握烯烃、醇、醛、羧酸之间的转化关系是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | SO2为0.4 mol•L-1、O2为0.2 mol•L-1 | |
| B. | SO2为0.25 mol•L-1 | |
| C. | SO2、SO3均为0.15 mol•L-1 | |
| D. | SO3为0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑥ | C. | ②③④ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | A2+与D2-的核外电子数相等 | |
| B. | B与E形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | 原子的失电子能力:C>A | |
| D. | 单质与浓度相等的稀盐酸反应的速率为B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁锈可用稀盐酸洗去 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 在Fe与稀H2SO4反应时,加几滴CuSO4溶液,可加快反应速率 | |
| D. | 红热的铁丝与水接触表面形成蓝黑色保护层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/L NaCl溶液中含有Na+个数为2NA | |
| B. | 常温常压下,80g NH4NO3中含有氮原子数是NA | |
| C. | 18gNH4+中含有的电子数为10NA | |
| D. | 5.6g铁与稀硝酸反应转移的电子数目一定为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
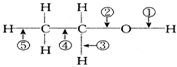
| A. | 和金属钠作用时,键①断裂 | |
| B. | 和浓H2SO4共热至170℃时,键②和⑤断裂 | |
| C. | 在Ag催化剂下和O2反应时,键①和③断裂 | |
| D. | 和CH2COOH共热时,键②断裂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com