
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
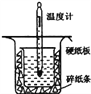
(1)从如图实验装置看,其中尚缺少的一种玻璃用品是___________________。
(2)若改用60mL 0.25 molL-1H2SO4和50mL 0.55molL-1NaOH溶液进行反应与上述实验相比,所放出的热量_____________(填“相等”“不相等”),若实验操作均正确,则所求中和热______(填“相等”“不相等”)
(3) 写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):_____________________________________。
(4)某学生实验记录数据如下:
实验 | 起始温度t1/℃ | 终止温度t2/℃ | |
序号 | 硫酸 | 氢氧化钠溶液 | 混合溶液 |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=__________(结果保留一位小数)。
(5)上述实验数值结果与57.3kJ/mol 有偏差,产生偏差的原因可能是________________________。
a.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.实验装置保温、隔热效果差
【答案】 环形玻璃搅拌棒 不相等 相等 HCl(aq)+NaOH(aq)=NaC l(aq)+H2O(l) △H=-57.3kJmol-1 -51.8 acd
【解析】(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;(2)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL 0.25 molL-1H2SO4和50mL 0.55molL-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;(3) 中和热数值为57.3kJ/mol,故稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式为:HCl(aq)+NaOH(aq)=NaC l(aq)+H2O(l) △H=-57.3kJmol-1;(4)第一次测定温度差为:(23.2-20.05)℃=3.15℃,第二次测定的温度差为:(23.4-20.3)℃=3.1℃,第三次测定的温度差为:(23.6-20.55)℃=3.05℃,三次温度差的平均值为: ![]() ℃=3.1℃;50mL0.55mol/L氢氧化钠与50mL0.25mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:100mL×1g/cm3=100g,温度变化的值为△T=3.1℃,则生成0.025mol水放出的热量为:Q=mc△T=100g×4.18J/(g℃)×3.1℃=1295.8J,即1.2958KJ,所以实验测得的中和热△H=-
℃=3.1℃;50mL0.55mol/L氢氧化钠与50mL0.25mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:100mL×1g/cm3=100g,温度变化的值为△T=3.1℃,则生成0.025mol水放出的热量为:Q=mc△T=100g×4.18J/(g℃)×3.1℃=1295.8J,即1.2958KJ,所以实验测得的中和热△H=-![]() =-51.8 kJ/mol;(5)a.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,选项a正确;b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,选项b错误;c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,选项c正确;d.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,选项d正确;答案选项acd。
=-51.8 kJ/mol;(5)a.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,选项a正确;b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,选项b错误;c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,选项c正确;d.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,选项d正确;答案选项acd。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某温度下,反应 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(molL﹣1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是( )
A.CH3OH的起始浓度为1.04mol/L
B.此时逆反应速率大于正反应速率
C.平衡时CH3OH的浓度为0.04mol/L
D.平衡时CH3OH的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a KJ·mol-1 (a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b KJ·mol-1 (b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应)的整个过程中转移电子的物质的量为_____mol,放出的热量为_________ kJ(用含有a和b的代数式表示)。
(2)己知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H=-870.3kJ/mo1
②C(s)+O2(g) =CO2(g) ΔH=-393.5kJ/mo1
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH=-488.3kJ/mo1
请写出H2燃烧热的热化学方程式______________________________________。
(3)在101kPa下,CH4(g)、H2(g)、C(s) 的燃烧热分别为890.3kJ/mol、285.8kJ/mol 和393.5kJ/mol,则CH4(g)分解为H2(g)、C(s)的热化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体黑磷,其转化过程中能量变化如图所示.下列叙述中正确的是( ) 
A.黑磷比白磷稳定
B.黑磷与白磷互为同分异构体
C.白磷转化为黑磷是氧化还原反应
D.白磷转化为黑磷是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为4MgCO3Mg (OH)25H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下方案: 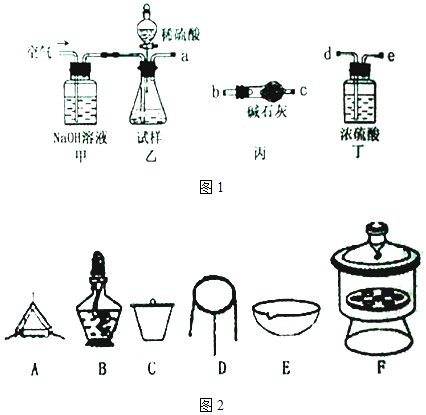
方案I 取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度
(1)乙中发生反应的方程式为 .
(2)仪器接口的连接顺序为(装置如图1可以重复使用)a , 丁的作用是 .
(3)当样品充分反应完后,缓慢通入空气的目的是 .
(4)方案 II①称取碱式碳酸镁样品mg;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g 下列仪器如图2中,该方案不会用到的是 .
(5)判断样品完全分解的方法是;本实验至少需要称量次.
(6)有同学认为方案 II高温煅烧的过程中会发生4MgCO3+SiO2 ![]() MgSiO3+CO2↑会导致测定结果有误,你认为这位同学的观点正确吗?(填“正确”或“错误”)请说明理由: .
MgSiO3+CO2↑会导致测定结果有误,你认为这位同学的观点正确吗?(填“正确”或“错误”)请说明理由: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用右图所示装置制备乙酸乙酯。实验如下:( )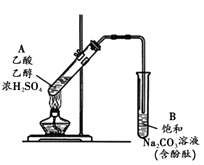
① 向浓H2SO4乙醇混合液中滴入乙酸后,加热试管A
② 一段时间后,试管B中红色溶液上方出现油状液体
③ 停止加热,振荡试管B,油状液体层变薄,下层红色溶液褪色
④ 取下层褪色后的溶液,滴入酚酞后又出现红色
结合上述实验,下列说法正确的是
A.①中加热利于加快酯化反应速率,故温度越高越好
B.③中油状液体层变薄主要是乙酸乙酯溶于Na2CO3溶液所致
C.③中红色褪去的原因可能是酚酞溶于乙酸乙酯中
D.取②中上层油状液体测其,共有3组峰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com