
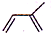
化合物A是合成天然橡胶的单体,分子式为C5H8,A的一系列反应如下(部分反应条件略去)
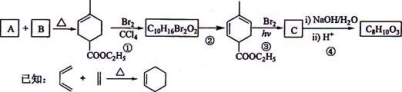
回答下列问题:
(1)A的结构简式为 ,化学名称是 ;
(2)B的分子式为 ;
(3)②的反应方程式为 ;
(4)①和③的反应类型分别是 , ;
(5)C为单溴代物,分子中有两个亚甲基,④的化学方程式为 ;(6)A的同分异构体中不含聚集双烯(C=C=C)结构单元的链状烃还有 种,写出其中互为立体异构体的化合物的结构简式 。
(1) 2-甲基-1,3-丁二烯(异戊二烯)
2-甲基-1,3-丁二烯(异戊二烯)
(2)C5H8O2
(3)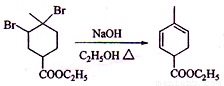
(4)加成反应 取代反应
(5)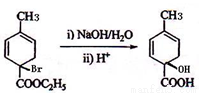
(6)6 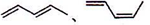
【解析】通过本题训练,熟悉有机推断的技巧和步骤。
一、确定官能团种类:
1、根据反应条件的试剂及反应现象确定官能团的种类,如H2/Ni,加成反应,可能含有碳碳双键、碳碳叁键、醛基或羰基、芳环等;FeCl3溶液显色反应,即碳架有苯环且苯环上连接有酚羟基等;
2、根据官能团的衍变,注意官能团的位置变化;
3、根据定量关系,确定官能团的数目;根据合成路径变化,留意官能团的保护,如即有碳碳双键又有羟基,先通过与HCl加成把碳碳双键隐藏,再氧化,然后消去;
二、左顾右盼,观察碳干变化,这是构建碳碳架的核心,主要体现是,碳干不变,碳干增加或减少,如何构建借助于官能团衍变化,反应类型中键的破与立,以及信息反应等。
三、寻找突破点
同时官能团名称的书写,消灭错别字;反应类型的判断;化学方程式的规范表达,防止漏写小分子,少写多写氢原子,没有配平等;同分异构体种类判断,注意两条线索及一个排布。一线索是芳醇→酚→芳醚;一线索是酯基(特别注意甲酸某酯)→羧基→醛基+羟基→碳碳双键+羟基;一个排布,就是环上的位置,往往设置最多的是环上的对称。
C5H8可推知其不饱和度为2,是合成天然橡胶单体,框图中还有暗示,则A为异戊二烯。分解A、B合成的产物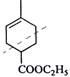 ,则A为
,则A为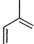 ,B为
,B为 。
。
反应①与溴反应,且产物只增加了2个溴原子,为碳碳双键的加成反应,但经反应②后却增加了2个碳碳双键,所以反应②只能是消去反应的结果。反应③的条件有些怪,不会是加成反应,且题中提示产物C为单溴代物,且有两个亚甲基,则只能是取代,还只能是在环上与酯基相连的那个碳上才符合题目要求,则C的结构简式为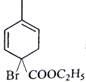 ;这个结构在氢氧化钠水溶液下水解再酸化,反应④就简单了。(6)小题中异构体要注意立体异构,这在后面的提问中做出了明确的提示。但题中并没有要求只写二烯烃异构,因而还得注意炔类的异构。这些异构体的碳链结构为
;这个结构在氢氧化钠水溶液下水解再酸化,反应④就简单了。(6)小题中异构体要注意立体异构,这在后面的提问中做出了明确的提示。但题中并没有要求只写二烯烃异构,因而还得注意炔类的异构。这些异构体的碳链结构为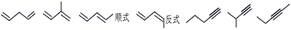 ,共7种,除本身外还有6种。
,共7种,除本身外还有6种。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:简答题
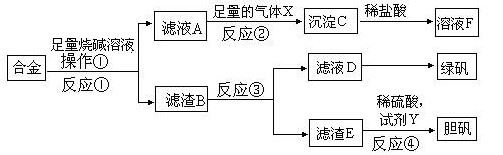
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
请回答:
(1)绿矾的化学式为 。
(2)写出反应①的 化学方程式 ,
化学方程式 ,
反应②生成沉淀的离子反应方程式 。
(3)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选): 。
(4)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是 。
(5)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为无色液体,则反应④的总化学方程式为 ;若不考虑绿色化学工艺,所选试剂Y为1mol/L的硝酸,欲使3molCu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积 L。
碱石灰
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:简答题
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。
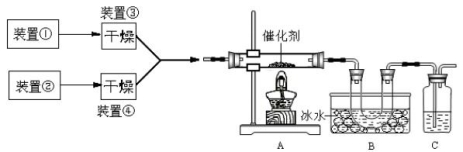
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验
证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生
反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气
体生成且越接近U型管底部颜色越浅,请解释原因 。
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中
若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
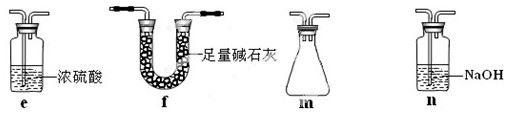
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制
NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
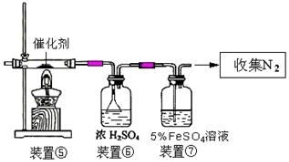
请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:选择题
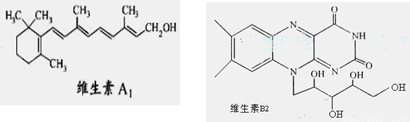
维生素A1、B2的结构简式分别如图所示:
已知: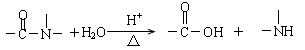
下列说法正确的是
A.1mol维生素A1最多与溴水中的4molBr2发生加成反应
B.维生素A1的分子式为C19H30O,是一种易溶于水的高分子。
C.维生素B2在酸性条件下彻底水解后得到的有机物,其分子内发生酯化得多种酯
D.用-C4H9取代维生素B2苯环上的一个H原子,最多可得4种同分异构体
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测2 题型:选择题
下列反应的离子方程式正确的是
A.Na2CO3溶液与NaHSO4溶液反应:CO32--+2H+=CO2↑+H2O
B.向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓
C.碘化钾溶液中滴入稀硫酸酸化的双氧水反应:2I-+H2O2+2H+=H2O+I2
D.海水制取溴时用纯碱吸收吹出的溴:3Br2+3H2O=5Br-+BrO3-+6H+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:推断题
如图所示的无机物的转化关系中,部分生成物和反应条件已略去。其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子。
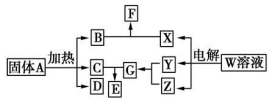
(1)写出X的电子式:________________ ;E中含有的化学键类型是________________。
(2)Z与C以物质的量之比3?1反应也能生成G,同时生成另一种二元化合物H,已知该反应中只有一种元素的化合价发生改变,则H的化学式为________________。H大量用于面粉的漂白和消毒,它与水反应的化学方程式为________________。
(3)将体积均为560 mL(标准状况)的B和Z同时缓缓通入水中,得到1.0 L溶液,则溶液中c(H+)=________mol/L。
(4)A~G七种物质中,属于电解质的有________种。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:选择题
关于下列各图的叙述中不正确的是

A.已知CO的燃烧热为283 kJ/mol,2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B.某温度下,pH=11的NH3·H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+ 、NH3·H2O与NH3三种微粒的平衡浓度之和为0.05 mol·L-1
C.在常温下,X2(g)和H2反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱
D.图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,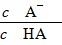 的变化情况
的变化情况
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
有M、X、Y、Z、W五种原子序数依次增大的短周期元素,其中M、Z同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法正确的是
A.X、M两种元素形成的化合物只能存在离子键
B.元素Y、Z、W形成的单质中,每1 mol它们的单质均含有NA个分子
C.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
D.元素W和M的某些单质可作为水处理中的消毒剂
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:实验题
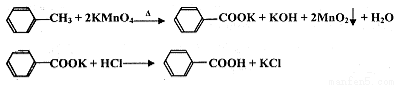
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g。
实验流程:
①往装置A中加入2.7mL(2.3 g)甲苯和125 mL水,然后分批次加入8.5 g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热。
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品。
③纯度测定:称取1.220g白色样品,配成100mL,甲醇溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示列举:
| 第一次 | 第二次 | 第三次 | 第四次 |
体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
请回答:
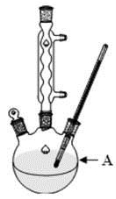
(1)装置A的名称 。若不用温度计,本实验控制反应温度的措施为 。
(2)白色粗产品中除了KCl外,其他可能的无机杂质为 。
(3)操作I的名称 。
(4)步骤③中用到的定量仪器有 ,100mL容量瓶,50mL酸式、碱式滴定管。
(5)样品中苯甲酸纯度为 。
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果 (填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com