
已知元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
则①与YZ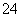 互为等电子体的分子的化学式:________(任写一种)。
互为等电子体的分子的化学式:________(任写一种)。
②X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为________。
③Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是________________。
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C、D是同一周期的非金属元素。A原子的L层p轨道中有2个电子,C是地壳内含量(质量分数)最高的元素,D在元素周期表的各元素中电负性最大,E的原子序数为24。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为____________,D的元素符号是________;
(2)E的元素符号是________,它位于第________周期,它的核外电子排布式为___,在形成化合物时它的最高化合价为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下列说法是否正确,正确的划“√”,错误的划“×”
(1)氢键是氢元素与其他元素形成的化学键( )
(2)可燃冰(CH4·8H2O)中甲烷分子与水分子间形成了氢键( )
(3)乙醇分子和水分子间只存在范德华力( )
(4)碘化氢的沸点高于氯化氢的沸点是因为碘化氢分子间存在氢键( )
(5)水分子间既存在范德华力,又存在氢键( )
(6)氢键具有方向性和饱和性( )
(7)H2和O2之间存在氢键( )
(8)H2O2分子间存在氢键( )
(9)卤素单质、卤素氢化物、卤素碳化物(即CX4)的熔、沸点均随着相对分子质量的增大而增大( )
(10)氢键的存在一定能使物质的熔、沸点升高( )
(11)极性分子中可能含有非极性键( )
(12)H2O比H2S稳定是因为水分子间存在氢键( )
查看答案和解析>>
科目:高中化学 来源: 题型:
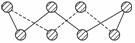
S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物,则NH3分子的空间构型是________;N2H4分子中氮原子轨道的杂化类型是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质变化,只与范德华力有关的是________。
A.干冰熔化
B.乙酸汽化
C.乙醇与丙酮混溶
D.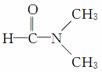 溶于水
溶于水
E.碘溶于四氯化碳
F.石英熔融
(4)下列物质中,只含有极性键的分子是____________,既含离子键又含共价键的化合物是________________;只存在σ键的分子是________,同时存在σ键与π键的分子是________________________________________________________________________。
A.N2 B.CO2 C.CH2Cl2 D.C2H4 E.C2H6 F.CaCl2 G.NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O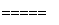 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
请回答下列问题:
(1)高铁电池的负极材料是________。
(2)放电时,正极发生________(填“氧化”或“还原”)反应;已知负极反应为Zn-2e-+2OH-===Zn(OH)2,则正极反应为__________________________________________________。
(3)放电时,________(填“正”或“负”)极附近溶液的碱性增强。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:________________________________________________________________________
与盐酸反应最剧烈,________________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:________________________________________________________________________
________________________________________________________________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
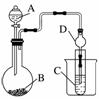
(3)仪器A的名称为______,干燥管D的作用是________________________________________________________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为________________________________________________________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com