
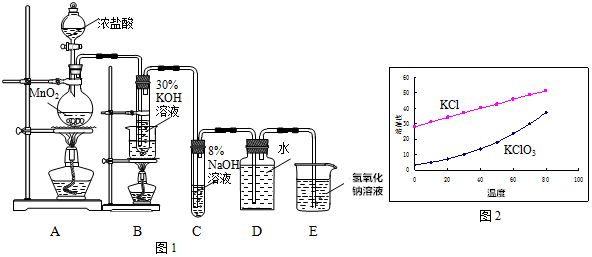
分析 制取氯水、氯酸钠、次氯酸钠:A装置:用浓盐酸和二氧化锰在加热条件反应,MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,制取氯气,B装:试管里盛有15mL30%NaOH溶液来制取氯酸钠,并置于热水浴中,C装置:试管里盛有15mL8%NaOH溶液来制取次氯酸钠,并置于冰水浴中;D装置:试管里加有水,制取氯水,E装置:为尾气吸收装置.
(1)氯水见光易分解,应保存在棕色细口瓶中;氯水溶液中存在的分子为Cl2、H2O、HClO,存在的离子为H+、Cl-、ClO-、OH-,据此分析加入碳酸钙溶液中溶质的成分;
(2)氯气通入氢氧化钾溶液在70℃~80℃发生反应生成氯酸钾、氯化钾和水;若有少量MnO2进入试管B,则会生成K2MnO4,依据氧化还原反应分析可知二氧化锰做氧化剂在碱性溶液中氧化氯气生成氯化钾,结合原子守恒配平书写化学方程式;
(3)制备NaClO需在0℃~5℃进行,温度控制可以用冰水混合物,温度过高还会生成NaClO3,当n(NaClO):n(NaClO3)=1:a时,依据氧化还原反应电子守恒计算;
(4)实验过程分析氯气和30%氢氧化钾溶液反应在70℃~80℃发生反应生成氯酸钾、氯化钾和水,在0℃~5℃氯气和8%KOH溶液反应生成氯化钾、次氯酸钾和水;
(5)溶解度图象分析可知同一温度下,KCl溶解度比KClO3大.
解答 解:(1)氯水在空气中久置变质,发生Cl2+H2O═HCl+HClO,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,氯水见光会分解,应保存在棕色细口瓶中,氯水中存在化学平衡Cl2+H2O?HCl+HClO,溶液中氯气呈黄绿色,溶液呈淡黄绿色,其中成分为Cl2、H2O、HCl、HClO,其中HCl是强电解质完全电离,HClO是弱电解质,溶液中存在的分子为Cl2、H2O、HClO,存在的离子为H+、Cl-、ClO-、OH-,向氯水中加入一定量的碳酸钙,碳酸钙与溶液中的氢离子反应,促进氯水的电离平衡正向移动,一份加热有白色沉淀产生,为微溶的氢氧化钙,形成的溶液中溶质的成分是Ca(ClO)2,
故答案为:保存在棕色细口瓶中;Ca(ClO)2;
(2)氯气通入氢氧化钾溶液在70℃~80℃发生反应生成氯酸钾、氯化钾和水,反应的离子方程式为:3Cl2+6OH-=5Cl-+ClO3-+3H2O,
故答案为:3Cl2+6OH-=5Cl-+ClO3-+3H2O;
(3)制备NaClO需在0℃~5℃进行,实验中宜采取的措施是将装置C放在冰水浴中,温度过高还会生成NaClO3,当n(NaClO):n(NaClO3)=1:a时,依据氧化还原反应电子守恒:(3a+1)Cl2+(6a+2)KOH=aKClO3+KClO+(5a+1)KCl+(3a+1)H2O),该反应中n(Cl2):n(NaOH)=1:2,
故答案为:将装置C放在冰水浴中;1:2;
(4)实验过程分析氯气和30%氢氧化钾溶液反应在70℃~80℃发生反应生成氯酸钾、氯化钾和水,在0℃~5℃氯气和8%KOH溶液反应生成氯化钾、次氯酸钾和水,温度不同、碱溶液浓度不同,生成产物不同,
故答案为:碱溶液(或反应物)的浓度不同,反应温度不同;
(5)KClO3、KCl的溶解度曲线分析可知同一温度下,KCl溶解度比KClO3大,反应结束后,从装置B中获得氯酸钾晶体的实验方案是冷却结晶,过滤洗涤,
故答案为:冷却结晶,过滤洗涤.
点评 本题考查了氯元素的化合物制备,反应物浓度不同,反应温度不同得到反应产物不同、化学方程式书写和氧化还原反应电子守恒等,注意氯气和碱溶液反应产物的判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | a | b | c | 现象 | 结论 | 装置 |
| A | 稀盐酸 | 大理石 | Na2SiO3溶液 | c中有白色胶状沉淀生成 | H2CO3酸性大于H2SiO3 |  |
| B | 浓盐酸 | MnO2 | 石蕊 试液 | 石蕊试液先 变红后褪色 | 氯气具有漂白性 | |
| C | 稀硫酸 | 锌粒 | 水 | 一段时间有气泡 | 反应生成了H2 | |
| D | NaOH溶液 | Al | 水 | 产生大量气泡 | Al能与NaOH 溶液反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | C和D物质的量浓度相等 | ||
| C. | 混合气体的密度 | D. | 混合气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4没有同分异构体 | B. | CH3Cl没有同分异构体 | ||
| C. | CH2Cl2没有同分异构体 | D. | CCl4没有同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 已知2CO(g)+O2(g)=2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ | |
| C. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H═2×(-57.3)kJ•mol-1 | |
| D. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)$?_{500℃/30Mpa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是在反应②中既是氧化产物又是还原产物 | |
| B. | 氧化性强弱的顺序为:BrO3->ClO3->Cl2>Fe3+ | |
| C. | 溶液中可发生:ClO3-+6Fe2++6H+═Cl-+6Fe3++3H2O | |
| D. | Cl2在①、③反应中均作氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com