
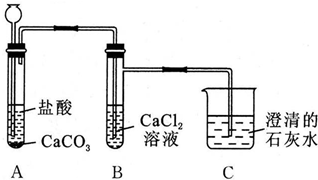
分析 由实验装置可知,A中发生盐酸与碳酸钙反应生成氯化钙和二氧化碳,由于弱酸不能制强酸,二氧化碳与氯化钙不反应,二氧化碳为酸性氧化物,与氢氧化钙反应生成白色沉淀碳酸钙,结合离子方程式中难溶物不能拆分成离子形式来解答.
解答 解:由实验装置可知,A中发生盐酸与碳酸钙反应生成氯化钙和二氧化碳,由于弱酸不能制强酸,二氧化碳与氯化钙不反应,二氧化碳为酸性氧化物,与氢氧化钙反应生成白色沉淀碳酸钙,
(1)A中发生CaCO3+2H+═Ca2++CO2↑+H2O,观察到有气体产生,固体不断减少,故答案为:有气体产生,固体不断减少;CaCO3+2H+═Ca2++CO2↑+H2O;
(2)装置B中的现象是无明显现象,故答案为:无明显现象;
(3)装置C中发生的现象是溶液变浑浊;此反应的离子方程式为Ca2++2OH-+CO2═CaCO3↓+H2O,故答案为:溶液变浑浊;Ca2++2OH-+CO2═CaCO3↓+H2O.
点评 本题考查性质实验方案的设计及实验装置综合,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意强酸制取弱酸的原理,题目难度不大.


 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si用于制造光导纤维 | |
| B. | 过氧化钠可用作潜艇供氧剂 | |
| C. | 水玻璃浸泡过的木材既能防腐又能耐火 | |
| D. | 常温下,铁槽、铝槽可存放冷的浓硝酸、浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5 mol/(L•s) | B. | v(B)=0.005 mol/(L•s) | ||
| C. | v(C)=0.8 mol/(L•min) | D. | v(D)=1.0 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | X | Y | Z | |
| 结构 或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解水生成H2、O2与H2在O2中燃烧生成H2O | |
| B. | H2和I2在高温下边化合边分解 | |
| C. | 溶解与结晶 | |
| D. | SO2通入品红溶液褪色,加热后又恢复红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8n | B. | 18n | C. | 13n | D. | 44n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na2SO3制备少量SO2:SO${\;}_{3}^{2-}$+2H+═SO2↑+H2O | |
| B. | Na2SO3溶液使酚酞试剂变红:SO${\;}_{3}^{2-}$+H2O═OH-+HSO${\;}_{3}^{-}$ | |
| C. | 用Ba(NO3)2溶液检验HSO${\;}_{3}^{-}$:HSO${\;}_{3}^{-}$+Ba2+═BaSO3↓+H+ | |
| D. | 用NaHSO3溶液检验H2S气体:2H2S+H++HSO${\;}_{3}^{-}$═3S↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com