
| 元素 | 原子结构或性质 |
| A | 原子最外层电子数是内层电子总数的1/5 |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
 .
. 分析 A~D六种元素中,除C外其他均为短周期元素,A原子最外层电子数是内层电子总数的$\frac{1}{5}$,则A有3各电子层,最外层电子数为2,故A为Mg;B是形成化合物种类最多的元素,其单质为固体,则B为碳元素;D元素是地壳中含量最多的元素,则D为O元素;C的单质是生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5,可知C为Fe元素.
解答 解:A~D六种元素中,除C外其他均为短周期元素,A原子最外层电子数是内层电子总数的$\frac{1}{5}$,则A有3各电子层,最外层电子数为2,故A为Mg;B是形成化合物种类最多的元素,其单质为固体,则B为碳元素;D元素是地壳中含量最多的元素,则D为O元素;C的单质是生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5,可知C为Fe元素.
(1)A为Mg元素,在元素周期表中的位置是:第三周期ⅡA族,故答案为:第三周期ⅡA族;
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是:Cu+2Fe3+=2Fe2++Cu2+,
故答案为:Cu+2Fe3+=2Fe2++Cu2+;
(3)用电子式表示MgCl2的形成过程: ,
,
故答案为: .
.
点评 本题考查结构性质位置关系应用,注意掌握电子式表示化学键或物质的形成过程,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 钠投入水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2 | |
| C. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+═2H2O+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
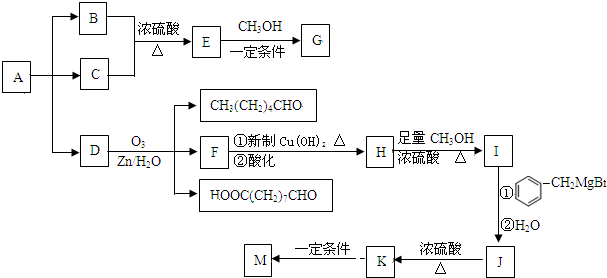
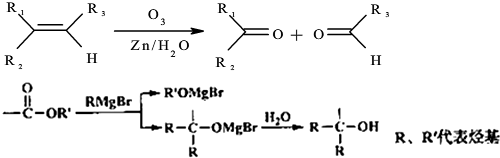
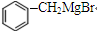 →
→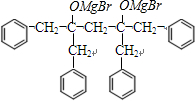 +2CH3OMgBr;
+2CH3OMgBr;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C、13C、14C、C60都是碳元素的同位素 | |
| B. | 同种元素的原子,质量数一定相同 | |
| C. | 互为同位素的原子,质子数一定相同 | |
| D. | 由一种元素组成的物质,一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数是K层的三倍 |
| X | 最高化合价为+7价 |
| Y | 短周期主族元素原子中半径最大 |
| Z | 地壳中含量最多的金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 | |
| B. | 结构简式为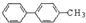 的烃,分子中含有两个苯环的该烃的同分异构体为4种 的烃,分子中含有两个苯环的该烃的同分异构体为4种 | |
| C. | 碳原子数小于或等于10的烷烃中其一氯代物只有一种的烷烃有4种 | |
| D. | 菲的结构简式为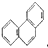 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与少量乙二醛混合可制备乙二酸 | |
| B. | 与浓盐酸反应的离子方程式为:2MnO4-+16 H++10Cl-=5Cl2↑+2Mn2++8 H20 | |
| C. | 与K+、NO3-、SO42-、CO32-可以大量共存 | |
| D. | 与过量Na202混合后,共转移e-0.05mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com