
| A. | 铁在潮湿的空气中易腐蚀 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | 往往需要在催化剂条件下SO2氧化成SO3 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.钢铁在潮湿的空气中容易生锈是电化腐蚀原理,不是可逆反应,不能用勒夏特列原理解释,故A不选;
B.增大压强,容器体积减小,二氧化氮浓度增大,气体颜色加深,平衡向四氧化二氮方向移动,使用后气体颜色变浅,可以用平衡移动原理解释,故B选;
C.催化剂只能改变反应速率但不影响平衡移动,则不能用平衡移动原理解释,故C不选;
D.氢气、碘反应生成HI的反应前后气体的物质的量之和不变,则压强不影响平衡移动,颜色加深是因为容器体积减小而导致碘浓度增大导致的,与平衡移动无关,所以不能用平衡移动原理解释,故D不选;
故选B.
点评 本题考查化学平衡移动原理,为高频考点,明确平衡移动原理内涵及适用范围是解本题关键,只有能引起平衡移动的才能用平衡移动原理解释,否则不能使用,注意B中颜色变化特点,虽然后来颜色变浅但仍然比平衡移动前颜色深,为易错点.


科目:高中化学 来源: 题型:推断题
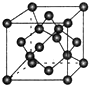 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
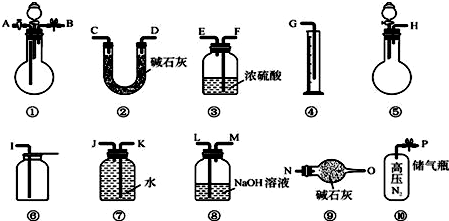
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
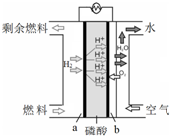
| A. | b极发生还原反应 | |
| B. | a极的反应式:H2+2OH--2e-═2H2O | |
| C. | 放电时,电子从b极经外电路流向a极 | |
| D. | 电池工作一段时间后,溶液中磷酸的浓度会升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
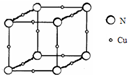 原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,W基态原子的除第四层只有1个电子外,其余内层均为全满结构.
原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,W基态原子的除第四层只有1个电子外,其余内层均为全满结构.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH增大,有O2放出 | B. | 溶质质量分数增大,有O2放出 | ||
| C. | 溶液c(Na+)增大,有O2放出 | D. | 溶液n(Na+)减小,有O2放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg+2HCl→MgCl2+H2↑ | B. | NaOH+HCl→NaCl+H2O | ||
| C. | H2O+CH3COOH?H3O++CH3COO- | D. | NH3+HCl→NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢:2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑ | |
| B. | 硫酸铁溶液中通入硫化氢气体:2Fe3++3H2S→2FeS↓+S↓+6H+ | |
| C. | 铝与氢氧化钠溶液反应:Al+2OH-→AlO2-+H2↑ | |
| D. | 已知25℃时,电离常数Ki (苯甲酸)>Ki1(H2CO3)>Ki (苯酚)>Ki2(H2CO3).常温下将水杨酸(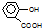 )与过量的Na2CO3溶液混合: )与过量的Na2CO3溶液混合: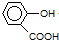 +2CO32-→ +2CO32-→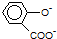 +2HCO3- +2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
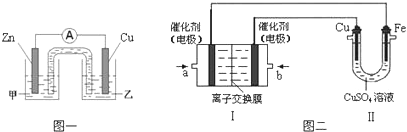
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com