
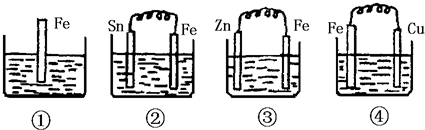
分析 ①铁为活泼金属,可与稀硫酸发生反应生成氢气,发生的是化学腐蚀,
②铁做负极,锡做正极,电解质溶液为硫酸,则负极铁发生氧化反应,正极发生还原反应,
③锌比铁活泼,做原电池的负极而被氧化,铁做正极被保护,
④铁做负极被腐蚀,铜做正极,
电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护.
解答 解:①铁为活泼金属,可与稀硫酸发生反应生成氢气,发生化学腐蚀,反应的离子方程式为Fe+2H+═Fe2++H2↑,
②B为原电池装置,Fe较活泼为原电池的负极,发生氧化反应被腐蚀,电极方程式为:Fe-2e=Fe2+,Sn为正极,发生还原反应,电极方程式为2H++2e-=H2↑,
③Zn比Fe活泼,形成原电池反应,锌被氧化,正极发生还原反应生成氢气,电极方程式为2H++2e-=H2↑,铁做正极被保护,
④铁做负极发生氧化反应被腐蚀,电极方程式为Fe-2e=Fe2+,铜做正极;
①发生化学腐蚀,②发生电化学腐蚀,③锌比铁活泼,铁做原电池的正极而被保护,④发生电化学腐蚀,其中两个电极活泼些相差越大铁腐蚀速率越大,②④都是铁做负极被腐蚀,④中电极金属活泼性相差大所以腐蚀速率快,
电化学腐蚀的速率大于化学腐蚀的速率,腐蚀速率由快到慢的顺序为④>②>①>③,
故答案为:④>②>①>③;
点评 本题考查金属的电化学腐蚀与防护,题目难度不大,注意金属的电化学腐蚀与化学腐蚀的区别,以及比较金属腐蚀快慢的方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CnH2n+2O的醇 | B. | CnH2nO的醛 | C. | CnH2nO2的羧酸 | D. | CnH2n+2的烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇、苯和溴苯 | |
| B. | 用饱和碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| C. | 用酸性高锰酸钾溶液鉴别乙烷、乙烯和二氧化硫气体 | |
| D. | 用溴水鉴别溴化钠、碘化钠和硫化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
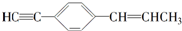 的说法正确的是( )
的说法正确的是( )| A. | 所有原子都在同一平面上 | |
| B. | 最多有5个碳原子在同一直线上 | |
| C. | 有7个碳原子可能在同一直线上 | |
| D. | 最多只能有9个碳原子在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
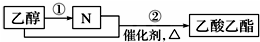
| A. | N为乙酸 | |
| B. | 可用饱和碳酸钠溶液除去乙酸乙酯中混有的N | |
| C. | 过程①中可加入LiAlH4等还原剂将乙醇转化为N | |
| D. | 过程②如果加热一段时间后发现忘记加碎瓷片,应停止反应,待冷却后补加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com