
����X������NH3��Cl2��HBr��CO2�е�һ�ֻ�����ɣ���֪Xͨ��AgNO3��Һʱ����dz��ɫ�������ó���������ϡHNO3������Xͨ�����ʯ��ˮ�У��������������й�����X�ijɷֵ�����˵����ȷ����( )
��һ������HBr�����ܺ���CO2 ��һ������CO2
��һ������NH3��Cl2 �ܿ��ܺ���Cl2��CO2��
A��ֻ�Т� B��ֻ�Т� C���ٺ͢� D���ں͢�
 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶��ϵ�һ���¿���ѧ���������棩 ���ͣ�ѡ����
��1molSO2��1molO2��ͨ��һ�����������ܱ������У���һ���¶Ⱥʹ��������£���Ӧ�ﵽƽ�⣬SO3Ϊ0.3mol ����ʱ����0.5molSO2��0.5molO2����Ӧ�ﵽ�µ�ƽ��ʱ��SO3�����ʵ�����( )
A��0.3 mol B��0.15mol
C����0.15mol D������0.15mol ����0.3mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������������ȷ����( )
A��Һ���ӷ����ڴ��Һ����Լ�ƿ��Ӧ��ˮ��
B����ʹ��ʪ�ĵ���KI��ֽ�����ɫ������һ����Cl2
C��ij��Һ����CCl4��CCl4������ɫ��֤��ԭ��Һ�д���I��
D��ij��Һ����BaCl2��Һ������������ϡ����İ�ɫ����������Һһ������Ag��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������10���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
ijͬѧ�����ͼ��ʾ��ʵ�鷽������ش��������⡣

(1)Aװ�õķ�Һ©����ʢװŨ���ᣬ��ƿ�й���Ϊ�ظ����(K2Cr2O7)����ԭ������(CrCl3)��д��A�з�Ӧ�����ӷ���ʽ ��
(2)Bװ�����������ã��ֱ��dz�ȥ�����е��Ȼ��⡢ ����ȥa���ܵĺ�������� ��
(3)U�ι�C��ʢװ�Ŀ����� (�����)��
��Ũ����ڼ�ʯ�Ң���ˮCaCl2
(4)֤����ķǽ����Աȵ�ǿ��ʵ������������� ��
(5)Eװ���н��е�ʵ��������Բ��㣬���� ����ҺX������ (�����)��
������������Һ������������Һ��������������Һ���Ȼ�������Һ�����⻯����Һ��̼��������Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
2011��11�£������۰˺š��ھ�Ȫ�������գ���ȡ��Բ���ɹ��������۰˺š������ػ������ȼ����ƫ������(C2H8N2)(����N�Ļ��ϼ�Ϊ��3)������������(N2O4)���ڻ�����չ����У�ȼ�Ϸ�����Ӧ��C2H8N2+2N2O4��2CO2+3N2+4H2O�ṩ�����������й�������ȷ����( )
A����ȼ����ɫ��������ȼ�չ����в�������κλ�����Ⱦ
B���÷�Ӧ��N2O4����������ƫ�������ǻ�ԭ��
C��N2���������������ǻ�ԭ���CO2�Ȳ�����������Ҳ���ǻ�ԭ����
D��ÿ��0.6 mol N2���ɣ�ת�Ƶ�����ĿΪ2.4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ������˵����ȷ����( )
A��������ΪNA��CO��C2H4�����������ԼΪ22.4 L
B����״���£�4.48 L��ˮ(D2O)�к��е�������Ϊ2NA
C����MnO2��Ũ������ȡCl2ʱ��ÿ����0.5mol Cl2��ת�Ƶ�����ΪNA
D��0.1 L 3.0 mol��L-1��NH4NO3��Һ�к���NH ����ĿΪ0.3NA
����ĿΪ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������10.6�ܲ⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�¶��£���һ�����0.1mol��L��1�Ĵ�����Һ����μ����Ũ�ȵ�NaOH��Һ����Һ��pOH(pOH=��lg[OH��])��pH�ı仯��ϵ��ͼ��ʾ��
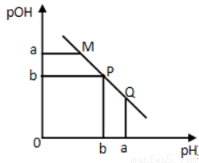
A��M����ʾ��Һ�ĵ�������ǿ��Q��
B��N����ʾ��Һ��c(CH3COO��)��c(Na+)
C��M���N����ʾ��Һ��ˮ�ĵ���̶���ͬ
D��Q������NaOH��Һ��������ڴ�����Һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������10.6�ܲ⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£���10mlbmol��L��1��CH3COOH��Һ�еμӵ������0.01mol��L��1��NaOH��Һ����ַ�Ӧ����Һ��c(CH3COO��)=c(Na+)������˵������ȷ����
A��b��0.01
B����Ϻ���Һ������
C��CH3COOH�ĵ��볣��Ka��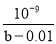
D����CH3COOH��Һ�еμ�NaOH��Һ�Ĺ����У�ˮ�ĵ���̶���С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡ�߶���10���¿���ѧ���������棩 ���ͣ�ѡ����
T��ʱ��ijһ��̬ƽ����ϵ�к���X(g)��Y(g)��Z(g)��W(g)�������ʣ����¶��·�����Ӧ��ƽ�ⳣ������ʽΪ��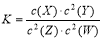 ���йظ�ƽ����ϵ��˵����ȷ����
���йظ�ƽ����ϵ��˵����ȷ����
A���÷�Ӧ�ɱ�ʾΪX(g) + 2Y(g) 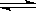 2Z(g) + 2W(g)
2Z(g) + 2W(g)
B����СXŨ�ȣ�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ��K��С
C������Ӧ������ѹǿ���÷�Ӧ����һ������
D�������¶ȣ�W(g)����������ӣ�������Ӧ�Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com