
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是
| 已知 | 类推 | |
| A. | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
| B. | 向稀硫酸中加入NaOH溶液至中性 H++OH-=H2O | 向H2SO4溶液中加入Ba(OH)2溶液至中性 H++OH-=H2O |
| C. | 向氯化铝溶液中加入足量NaOH溶液 Al3+ + 4OH- = AlO2- + 2H2O | 向氯化铝溶液中加入足量氨水 Al3+ + 4NH3·H2O = AlO2- + 2H2O +4NH4+ |
| D. | 向Ca(OH)2溶液中通入过量CO2 CO2 + OH- = HCO3- | 向Ca(OH)2溶液中通入过量SO2 SO2 + OH- = HSO3- |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
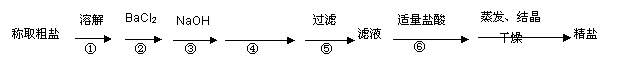 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)步骤②中的BaCl2溶液能否替换成以下溶液:( )
A.Ba(NO3)2溶液 B.Ba(OH)2溶液 C.A和B均可以 D.A和B均不可以
(2)第④步用到的试剂作用是 ;
(3)利用题干所给试剂,②③④所加试剂的顺序还可以为 (填化学式);
(4)判断BaCl2已过量的方法是 ;
(5)若先用盐酸调溶液至酸性,再过滤,将对实验结果产生影响,其可能的原因是(用相应的化学方程式表示) 。(任意写一个即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法中,不正确的是:
A.a mol/L的HCN溶液与b mol/L的NaOH溶液等体积混合,所得溶液中
c(Na+)>c(CN-),则a一定小于b
B.常温下,CH3COONa溶液的pH=8,则c(Na+) -c(CH3COO-)=9.9×10-7mol/L
C.常温下,0.1mol/L的某酸溶液中,若c(OH-)/c(H+) =1×10-8,则溶液中由水电离出的
c(H+) =1×10-11mol/L
D.在0.1 mol/L Na2SO3溶液中加入少量NaOH固体,c(SO32-)与c(Na+)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应,则两个过程中消耗的氯气的总的物质的量是
A.3mol B.4mol C.5mol D.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2气体通入BaCl2溶液中,未见白色沉淀,继续通入另一种气体立即产生沉淀,则通入的气体不可能的是
A.Cl2 B.NH3 C.H2S D.CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
将3.84 g Fe和Fe2O3的混合物溶于120 mL的盐酸,刚好完全反应,生成0.03 mol H2,若反应后的溶液中无Fe3+,且溶液体积不变,试求:
(1)原混合物中Fe2O3的质量为 ;
(2)原盐酸的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置设计正确、且能达到目的的是 ( )
|
|
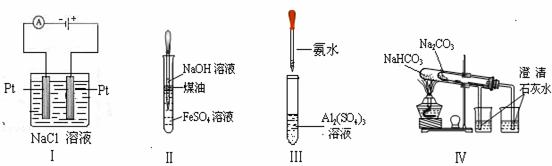
A.实验Ⅰ:制备金属钠 B.实验Ⅱ:制取氢氧化亚铁并观察其颜色
C.实验Ⅲ:制取少量的氢氧化铝 D.实验Ⅳ:比较两种物质的热稳定 性
性
查看答案和解析>>
科目:高中化学 来源: 题型:
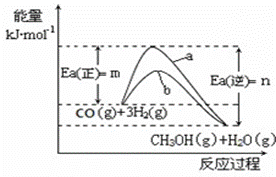 |  | ||
(1)写出合成甲醇反应的热化学方程式 ;
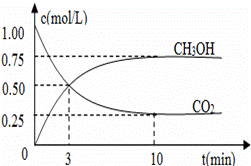
图1 图2
(2)在图中曲线 (填“a”或“b”)表示加入催化剂的能量变化曲线。
(3)在体积为l L的密闭容器中,充入lmolCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数为__________________,升高温度,K值 (填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O,则阴极反应式为:_______________________________ 。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:__________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.元素由化合态变成游离态时,它可能被氧化,也可能被还原
C.失电子难的原子,获得电子的能力一定强
D.有单质参加或生成的反应一定属于氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com