
分析 (1)根据盖斯定律,①+②可得目标热化学方程式;
(2)由于联氨是二元碱,因此联氨与过量盐酸反应生成为N2H6Cl2;
(3)从作为燃料电池时,负极发生氧化反应的角度可知N2H4被氧化生成N2;
(4)在高温下,N2H4可完全分解为NH3、N2及H2,根据N2与H2的物质的量之比为3:2书写方程式;
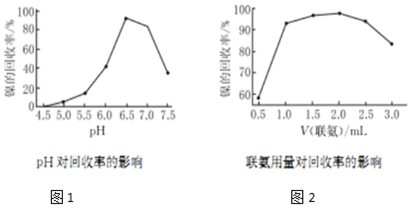
(5)根据图1所示,pH应控制在6.5时金属镍的回收率最高;根据图2联氨的合理用量为1.0〜2.5ml时,镍的冋收率较高,当联氨的体积超过2.5mL时,联氨用量增加,又联氨显碱性,则溶液pH增大,所以镍的回收率降低.
解答 解:(1)①NH3(g)+NaClO(aq)═NH2C1(I)+NaOH(aq)△H1=-67.45kJ•mol-1
②NH2Cl(1)+NaOH(aq)+NH3(g)═N2H4(I)+NaCl(aq)+H2O(I)△H2=-195.32kJ•mol-1
根据盖斯定律,①+②可得反应2NH3(g)+NaClO(ap)═N2H4(I)+NaCl(aq)+H2O(I)△H=-67.45kJ•mol-1-195.32kJ•mol-1=-262.77kJ•mol-1,
故答案为:-262.77;
(2)由于联氨是二元碱,因此联氨与过量盐酸反应生成为N2H6Cl2;则反应的离子方程式为N2H4+2H+=N2H62+,故答案为:N2H4+2H+=N2H62+;
(3)肼一空气燃料碱性电池中,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N2H4+4OH--4e-=4H2O+N2,故答案为:N2H4+4OH--4e-=N2+4H2O;
(4)在高温下,N2H4可完全分解为NH3、N2及H2,N2与H2的物质的量之比为3:2,所以分解反应方程式为:7N2H4$\frac{\underline{\;高温\;}}{\;}$8NH3+3N2+2H2,故答案为:7N2H4$\frac{\underline{\;高温\;}}{\;}$8NH3+3N2+2H2;
(5)根据图1所示,pH应控制在6.5时金属镍的回收率最高;根据图2联氨的合理用量为1.0〜2.5ml时,镍的冋收率较高,当联氨的体积超过2.5mL时,联氨用量增加,又联氨显碱性,则溶液PH增大,由图1可知,镍的回收率又降低,所以联氨的体积超过2.5mL时,金属镍的冋收率降低,其可能的原因是联氨显碱性,联氨用量增加,溶液pH增大,镍的回收率降低,故答案为:6.5;1.0〜2.5;联氨显碱性,联氨用量增加,溶液pH增大,镍的回收率降低.
点评 本题考查了联氨的性质,涉及盖斯定律计算应用、方程式及电极反应式的书写、图表信息的提取应用等,这些都是高考的热点,注意电极反应式的书写要结合电解质溶液的酸碱性,难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 分离苯和四氯化碳 | 用分液漏斗进行分液 |
| B | 制备Fe(OH)3胶体 | 向饱和FeCl3溶液中滴加氨水并不断搅拌 |
| C | 除去Na2CO3固体中的NaHCO3 | 用酒精灯灼烧固体混合物 |
| D | 制取NH3 | 直接加热NH4Cl固体,用向下排空气法收集气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
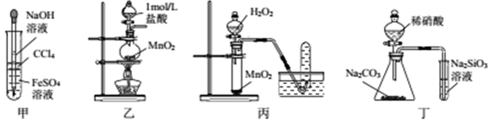
| A. | 用甲所示装置制取并观察Fe(OH)2 | |
| B. | 用乙所示装置制取少量Cl2 | |
| C. | 用丙所示装置制取O2 | |
| D. | 用丁所示装置比较N、C、Si的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关 | |
| B. | 标准状况下,2.24LCCl4分子中共价键的数目为0.4×6.02×1023 | |
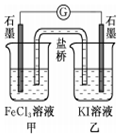
| C. | 控制适合的条件,将反应2Fe3++2I-═2Fe2++I2设计成如图所示的原电池.当电流汁读数为零后,在甲中溶入FeCl2固体,则乙中石墨电极为负极 | |
| D. | 向盛有2mL饱和H2S溶液的两支试管中分别滴加1滴浓度均为0.1mol/L的ZnSO4溶液和CuSO4溶液,有CuS生成而无ZnS生成,则Ksp(CuS)<Ksp(ZnS) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用酒精能使蛋白质变性,可用于消毒杀菌 | |
| B. | SiO2有很好的折光率,可以用来做半导体材料 | |
| C. | 水玻璃易溶于水,可用于生产黏合剂和防火剂 | |
| D. | 氯化铝是强电解质,可电解其水溶液获得金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| B. | 在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 | |
| C. | 11.2 g Fe在高温下与足量水蒸气反应,生成的H2分子数目为0.3×6.02×1023 | |
| D. | 室温下,体积、pH均相同的HA和HB两种酸分别与足量的锌反应,HA放出的氢气多,说明酸性HB>HA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
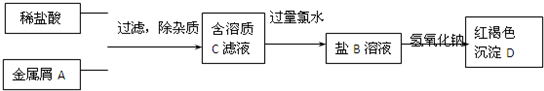
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO中混有Al2O3:加入过量烧碱溶液充分反应后过滤 | |
| B. | FeCl2溶液中混有CuCl2:加入过量铁粉充分反应后过滤 | |
| C. | Na2CO3固体中混有少量NaHCO3:加入过量NaOH溶液,反应后加热蒸干 | |
| D. | 乙烷中混有乙烯:将混合气体通过盛溴水的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023就是阿伏加德罗常数 | |
| B. | 1mol氧含 6.02×1023个 O2 | |
| C. | 1mol任何气体所含的气体分子数目都相等 | |
| D. | 摩尔是国际单位制中的一个基本物理量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com