
分析 (1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,滴加指示剂,然后用标准液进行滴定;
(2)因锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨;
(3)指示剂为甲基橙,变色范围为3.1-4.4,溶液颜色发生变化,且半分钟内不再恢复;
(4)根据c(待测)=$\frac{c(标)×V(标)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(5)根据消耗硫酸的体积和物质的量浓度利用关系式:H2SO4~2NaOH求出氢氧化钠的物质的量,再计算烧碱样品的纯度.
解答 解:(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,滴加指示剂,然后用标准液进行滴定,正确的操作步骤的顺序是C→A→B→D→E;
故答案为:C→A→B→D→E;
(2)因锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于准确判断终点时颜色的变化情况;
故答案为:便于准确判断终点时颜色的变化情况;
(3)指示剂为甲基橙,变色范围为3.1-4.4,终点时pH约为4.4,溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;
故答案为:溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;
(4)若酸式滴定管没有用标准H2SO4润洗,H2SO4被稀释,浓度偏小,造成V(标准)增大,c(待测)=$\frac{c(标)×V(标)}{V(待测)}$分析,可知c(待测)偏高;
故答案为:偏高;
(5)滴到消耗的硫酸为n(硫酸)=cV=(V2-V1)×10-3L×cmol/L,根据关系式:H2SO4~2NaOH可知,n(NaOH)=2n(硫酸)=2c(V2-V1)×10-3mol,所以原来样品中氢氧化钠的物质的量为:2c(V2-V1)×10-3mol×$\frac{250}{25}$=2c(V2-V1)×10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=80c(V2-V1)×10-2g,则该烧碱样品的纯度为:$\frac{80c({V}_{2}-{V}_{1})×1{0}^{-2}g}{mg}$×100%=$\frac{80c({V}_{2}-{V}_{1})}{m}$%,
故答案为:$\frac{80c({V}_{2}-{V}_{1})}{m}$%.
点评 本题主要考查了酸碱中和滴定的操作、误差分析以及有关的化学计算,难度中等,掌握中和滴定的原理是解题的关键.


科目:高中化学 来源: 题型:选择题
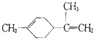 ; 有关柠檬烯的分析正确的是( )
; 有关柠檬烯的分析正确的是( )| A. | 柠檬烯的一氯代物有9种 | |
| B. | 柠檬烯和丁基苯 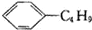 互为同分异构体 互为同分异构体 | |
| C. | 柠檬烯的分子中所有的碳原子可能在同一个平面上 | |
| D. | -定条件下,柠檬烯可以发生取代反应和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 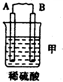 | 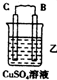 | 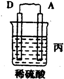 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 360 | p | 2.00 | 6.80 |
| 2 | t | 101 | 2.00 | 6.80 |
| 3 | 360 | 101 | 2.00 | 6.80 |
| CH4 | H2O | CO | H2 |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
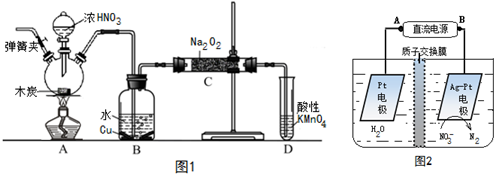
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
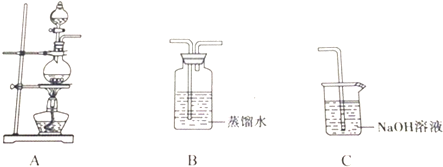
| 实验 | 实验操作 | 现象 | 结论 |
| Ⅰ | 向氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生了一种酸性强于碳酸的物质 |
| Ⅱ | 向品红溶液中滴入氯水 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径大小:S2->Cl->F->Na+>Al3+ | |
| B. | 热稳定性大小:SiH4<PH3<NH3<H2O<HF | |
| C. | 熔点高低:金刚石>石墨>食盐>干冰>碘晶体 | |
| D. | 沸点高低:NH3>AsH3>PH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com