
| A. | 氧化钙溶于水 | B. | 乙醇燃烧 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 断开1mol氮气分子中的氮氮叁键 |
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | A>C>D>B | C. | C>A>B>D | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色变化 | 证明二氧化碳具有漂白性 |
| B | 向2mL1mol•L-1NaOH溶液中先加入3滴1mol•L-1FeCl3溶液,再加入3滴1mol•L-1MgCl2溶液 | 证明Ksp[Mg(OH)2]>ksp[Fe(OH)3] |
| C | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴含NaClO的“84”消毒液,观察红色褪色的快慢 | 证明随着溶液pH的减小,“84”消毒液的氧化能力增强 |
| D | 相同温度下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液 | 探究Cu2+、Fe3+对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入澄清石灰水中 | B. | 稀硝酸中加入铜片 | ||
| C. | 稀硝酸中加入铁屑 | D. | HCl溶液滴入Na2CO3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力发展火力发电,解决电力紧张问题 | |
| B. | 在屋顶安装太阳能热水器为居民提供生活用热水 | |
| C. | 为了减少二氧化硫和二氧化氮的排放,工业废气排放到大气之前必须回收处理 | |
| D. | 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
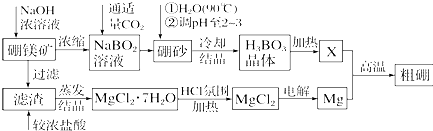
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
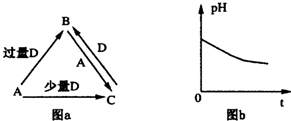
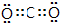 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L苯中含有的碳碳双键数目为1.5NA | |
| B. | 25℃时,1.0 L pH=12的Na2 CO3溶液中含有的阴离子数大于0.01NA | |
| C. | 标准状况下,2.8 g由N2和CO组成的混合气体中含有的原子数为0.1NA | |
| D. | 在反应:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2中,生成1 mol Cu,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com