
 £©£¬ŹĒ³£ÓĆµÄ½āČČÕņĶ“Ņ©£¬ŹµŃéŹŅŗĻ³ÉĮ÷³ĢČēĻĀ£ŗ
£©£¬ŹĒ³£ÓĆµÄ½āČČÕņĶ“Ņ©£¬ŹµŃéŹŅŗĻ³ÉĮ÷³ĢČēĻĀ£ŗ

 £®
£®

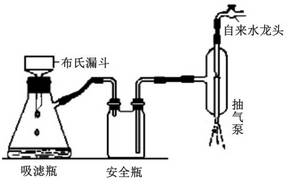
·ÖĪö £Ø1£©¢ŁøĆ·“Ó¦ĪĀ¶ČŌŚ85”«90”ęÖ®¼ä£¬µĶÓŚĖ®µÄ·Šµć£»
¢ŚŅŅĖįōūÄÜČÜÓŚĖ®Éś³É“×Ėį£»
¢ŪA£®æÅĮ£Ģ«Š”µÄ³ĮµķŅ×ŌŚĀĖÖ½ÉĻŠĪ³ÉŅ»²ćĆÜŹµµÄ³Įµķ£»
B£®ĀĖÖ½Ņ×±»ĒæĖį”¢Ēæ¼ī”¢Ńõ»ÆĪļĪļÖŹøÆŹ“£»
C£®µ±ĪüĀĖĘæÖŠŅŗĆęæģ“ļµ½Ö§¹ÜæŚĪ»ÖĆŹ±£¬Ó¦°ĪµōĪüĀĖĘæÉĻµÄĻšĘ¤¹Ü£¬“ÓĪüĀĖĘæÉĻæŚµ¹³öČÜŅŗ£»
D£®Ļ“µÓ¾§ĢåŹ±£¬ĻČ¹ŲŠ”Ė®ĮśĶ·£¬²»ŹĒ¹Ų±ÕĖ®ĮśĶ·£»
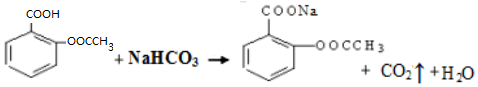
£Ø2£©ŅŅõ£Ė®ŃīĖįĪŖĪ¢ČÜÓŚĖ®µÄĪļÖŹ£¬¼ÓČėŃĪÖ®ŗóæÉŅŌ×Ŗ»ÆĪŖŅ×ČÜÓŚĖ®µÄŃĪ£¬Ņ×Óė²»ČÜŠŌŌÓÖŹ·ÖĄė£»
£Ø3£©¢Ł°¢Ė¾Ę„ĮÖÄŃČÜÓŚĖ®Ņ×ČÜÓŚŅŅ“¼£¬Ó¦øĆÓĆĖ®Ļ“µÓ£»
¢ŚÉĻŹöĮ÷³ĢÖŠÓŠ¼ÓČČ»ŲĮ÷”¢³éĀĖ”¢øÉŌļ²Ł×÷£»
¢ŪŃĒĪČ¹ż±„ŗĶĒųŹĒ“ÓøßĪĀÅØČÜŅŗÖŠ»ńµĆ½Ļ“ó¾§Ģ壮
½ā“š ½ā£ŗ£Ø1£©¢ŁøĆ·“Ó¦ĪĀ¶ČŌŚ85”«90”ęÖ®¼ä£¬µĶÓŚĖ®µÄ·Šµć£¬ĖłŅŌŠčŅŖĖ®Ō”¼ÓČČ£¬ĪĀ¶Č¼Ę²āĮæĖ®Ō”ĪĀ¶Č£¬¹ŹŃ”B£»
¢ŚŅŅĖįōūÄÜČÜÓŚĖ®Éś³É“×Ėį£¬ĪŖ·ĄÖ¹ŅŅĖįōūŗĶĖ®·“Ó¦¶ų½µµĶ²śĀŹ£¬ĖłŅŌ³É°¢Ė¾Ę„ĮÖŹ¹ÓƵÄ׶ŠĪĘæ±ŲŠėøÉŌļ£¬
¹Ź“š°øĪŖ£ŗ·ĄÖ¹ŅŅĖįōūŗĶĖ®·“Ó¦£»
A£®æÅĮ£Ģ«Š”µÄ³Įµķ²»ÄÜÓĆ³éĀĖµÄŌŅņŹĒæÅĮ£Ģ«Š”µÄ³ĮµķŅ×ŌŚĀĖÖ½ÉĻŠĪ³ÉŅ»²ćĆÜŹµµÄ³Įµķ£¬ČÜŅŗ²»Ņ×Ķø¹ż£¬¹ŹAÕżČ·£»
B£®¹żĀĖµÄČÜŅŗÓŠĒæŃõ»ÆŠŌ”¢Ēæ¼īŠŌ»ņĒæĖįŠŌŹ±£¬Ó¦Ń”²£Į§ĻĖĪ¬“śĢęĀĖÖ½£¬Ó¦Ź¹ÓĆ²£Į§É°Ā©¶·“śĢę²¼ŹĻĀ©¶·£¬¹ŹBÕżČ·£»
C£®µ±ĪüĀĖĘæÖŠŅŗĆęæģ“ļµ½Ö§¹ÜæŚĪ»ÖĆŹ±£¬Ó¦°ĪµōĪüĀĖĘæÉĻµÄĻšĘ¤¹Ü£¬“ÓĪüĀĖĘæÉĻæŚµ¹³öČÜŅŗ£¬¶ų²»ÄÜ“ÓĪüĀĖĘæÖ§¹ÜæŚµ¹³öČÜŅŗ£¬²Ł×÷²»ŗĻĄķ£¬¹ŹC“ķĪó£»
D£®Ļ“µÓ¾§ĢåŹ±£¬ĻČ¹ŲŠ”Ė®ĮśĶ·£¬²»ŹĒ¹Ų±ÕĖ®ĮśĶ·£¬Č»ŗóÕōĮóĖ®»ŗ»ŗĮÜĻ“£¬ŌŁ“ņæŖĖ®ĮśĶ·³éĀĖ£¬¹ŹD“ķĪó£»
¹ŹŃ”CD£»
£Ø2£©ŅŅõ£Ė®ŃīĖįĪŖĪ¢ČÜÓŚĖ®µÄĪļÖŹ£¬¼ÓČėŃĪÖ®ŗóæÉŅŌ×Ŗ»ÆĪŖŅ×ČÜÓŚĖ®µÄŃĪ£¬Ņ×Óė²»ČÜŠŌŌÓÖŹ·ÖĄė£¬·“Ó¦·½³ĢŹ½ĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ
£Ø3£©¢Ł°¢Ė¾Ę„ĮÖÄŃČÜÓŚĖ®Ņ×ČÜÓŚŅŅ“¼£¬Ó¦øĆÓĆĖ®Ļ“µÓ£¬NaOHŗĶ°¢Ė¾Ę„ĮÖÄÜ·“Ó¦£¬ĀĖŅŗÖŠŗ¬ÓŠŌÓÖŹ£¬ĖłŅŌÓĆĄäĖ®Ļ“µÓ£¬¹ŹŃ”C£»
¢ŚÉĻŹöĮ÷³ĢÖŠÓŠ¼ÓČČ»ŲĮ÷×°ÖĆC”¢³éĀĖ×°ÖĆD”¢øÉŌļ×°ÖĆA£¬ĖłŅŌ²»ŠčŅŖB×°ÖĆ£¬¹ŹŃ”B£»
¢ŪŃĒĪČ¹ż±„ŗĶĒų£¬¼ÓČė¾§ÖÖ£¬¾§ĢåÉś³¤£¬“Ó¶ųµĆµ½½Ļ“óæÅĮ£µÄ¾§Ģ壬Ōņ“ÓĪĀ¶Č½ĻøßÅØČÜŅŗÖŠ»ńµĆ½Ļ“ó¾§ĢåæÅĮ£µÄ²Ł×÷ĪŖŌŚŃĒĪČ¹ż±„ŗĶĒų¼ÓČė¾§ÖÖ£¬»ŗĀż½µĪĀ£¬
¹Ź“š°øĪŖ£ŗŌŚŃĒĪČ¹ż±„ŗĶĒų¼ÓČė¾§ÖÖ£¬»ŗĀż½µĪĀ£®
µćĘĄ ±¾Ģāæ¼²éÖʱøŹµŃé·½°øÉč¼Ę£¬ĪŖøßĘµæ¼µć£¬²ąÖŲæ¼²éѧɜŹµŃé²Ł×÷”¢ŹµŃé·ÖĪöŗĶĘĄ¼Ū¼°ŠÅĻ¢µÄ»ńČ”ŗĶÓ¦ÓĆÄÜĮ¦£¬Ć÷Č·ŹµŃéŌĄķ”¢ĪļÖŹŠŌÖŹŹĒ½ā±¾Ģā¹Ų¼ü£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
 ³£¼ūĪŽ»śĪļA”¢B”¢C”¢D“ęŌŚČēĶ¼×Ŗ»Æ¹ŲĻµ£ŗ
³£¼ūĪŽ»śĪļA”¢B”¢C”¢D“ęŌŚČēĶ¼×Ŗ»Æ¹ŲĻµ£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2.82gĒąŻļĖŲŗ¬ŃõŌ×ÓŹżÄæĪŖ0.05NA | |
| B£® | ±ź×¼×“æöĻĀ£¬1 molĒąŻļĖŲµÄĢå»żĪŖ22.4 L | |
| C£® | ĒąŻļĖŲŗ¬ŃõĮæĪŖ10% | |
| D£® | ĒąŻļĖŲµÄĦ¶ūÖŹĮæĪŖ282 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | AgClŌŚ±„ŗĶNaClČÜŅŗÖŠµÄ KSP ±ČŌŚ“æĖ®ÖŠµÄ KSP Š” | |
| B£® | ĻņAgClµÄŠü×ĒŅŗÖŠ¼ÓČėNaBrČÜŅŗ£¬°×É«³Įµķ×Ŗ»ÆĪŖµ»ĘÉ«£¬ĖµĆ÷KSP £ØAgCl£©£¼KSP £ØAgBr£© | |
| C£® | ½«0.001 mol•L- 1 µÄAgNO3 ČÜŅŗµĪČė0.001 mol•L- 1 µÄKClŗĶ0.001 mol•L- 1 µÄK2CrO4 ČÜŅŗÖŠĻČ²śÉśAg2CrO4 ³Įµķ | |
| D£® | ĻņAgClµÄŠü×ĒŅŗÖŠµĪ¼ÓÅØ°±Ė®£¬³ĮµķČܽā£¬ĖµĆ÷AgClµÄČܽāĘ½ŗāĻņÓŅŅĘ¶Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
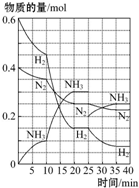 500”ę”¢20MPaŹ±£¬½«H2ŗĶN2ÖĆÓŚŅ»ČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗ3H2+N2?2NH3”÷H£¼0£®·“Ó¦¹ż³ĢÖŠH2”¢N2ŗĶNH3ĪļÖŹµÄĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬¾ŻĶ¼ÅŠ¶ĻĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ£Ø””””£©
500”ę”¢20MPaŹ±£¬½«H2ŗĶN2ÖĆÓŚŅ»ČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗ3H2+N2?2NH3”÷H£¼0£®·“Ó¦¹ż³ĢÖŠH2”¢N2ŗĶNH3ĪļÖŹµÄĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬¾ŻĶ¼ÅŠ¶ĻĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | ·“Ó¦æŖŹ¼µ½µŚŅ»“ĪĘ½ŗāŹ±£¬N2µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.062 5 mol•L-1•min-1£¬H2µÄ×Ŗ»ÆĀŹĪŖ75% | |
| B£® | ·“Ó¦35 minŹ±£¬“ļµ½µŚ¶ž“ĪĘ½ŗāŹ±£¬·“Ó¦µÄĘ½ŗā³£Źż£ŗK=$\frac{0.1{5}^{2}}{0.07{5}^{3}•0.125}$ | |
| C£® | “ÓĒśĻß±ä»ÆæÉŅŌ擳ö£¬·“Ó¦½ųŠŠµ½10”«20 minŹ±æÉÄܲÉČ”µÄ“ėŹ©ŹĒŹ¹ÓĆĮĖ“߻ƼĮ | |
| D£® | “ÓĒśĻß±ä»ÆæÉŅŌ擳ö£¬·“Ó¦½ųŠŠÖĮ25 minŹ±£¬²ÉČ”µÄ“ėŹ©ŹĒ·ÖĄė³ö0.1 molµÄ°±Ęų£¬Ę½ŗāĻņÕż·½ĻņŅĘ¶Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| Ź±¼ät/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| ×ÜŃ¹Ēæp/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼°Ź±°ŃÉś³ÉµÄ°±Ņŗ»Æ·ÖĄė | B£® | ÉżĪĀÓŠĄūÓŚ°±µÄÉś³É | ||
| C£® | Ź¹ÓĆ“ß»Æ¼Į“Ł½ųµŖµÄ×Ŗ»Æ | D£® | Ōö“óŃ¹Ē棬²»ĄūÓŚ°±µÄÉś³É |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
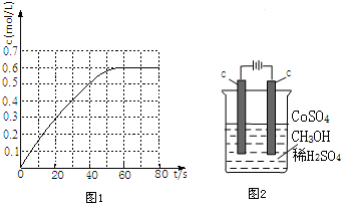
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com