
【题目】工业上生产玻璃的原料是___________ 、_____________ 、_______________;有关的反应原理有:__________________________________、_________________________________。
科目:高中化学 来源: 题型:
【题目】2017年6月5日是世界环境日,中国主题为“绿水青山就是金山银山”氮的氧化物的污染日趋严重,某企业处理该污染物的原理设计为燃料电池如右图所示。在处理过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。下列说法不正确的是
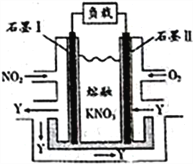
A. 该电池放电时电子流动的方向是:石墨Ⅰ电极→负载→石墨Ⅱ电极→熔融KNO3→石墨Ⅰ电极
B. 石墨Ⅱ附近发生的反应:O2+4e-+2N2O5=4NO3-
C. O2在石墨Ⅱ附近发生还原反应,Y为N2O5
D. 相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围很广,请回答下列问题:
制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)写出由纯SiHCl3制备高纯硅的化学反应方程式___________;
(2)整个制备过程必须严格控制无水无氧,SiHCl3遇水剧烈反应生成H2SiO3,HCl和另一种物质,写出配平的化学反应方程式___________; H2还原SiHCl3过程中若混入O2,可能引起的后果是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其氧化物是日常生活生产中应用广泛的材料。请回答下列问题:
(1)基态铁原子的价电子排布图为_______
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+_____Fe3+(填“大于”或“小于”),原因是____。
(3)纳米氧化铁能催化火管推进剂NH4ClO4的分解,NH4+的结构式为______(标出配位键),其中氮原子的杂化方式为______;与 ClO4-互为等电子体的分子或离子为_________(任写两种)。
(4)金属铁晶体原子采用体心立方堆积。则铁晶体的空间利用率为____ (用含π的式子表示)。
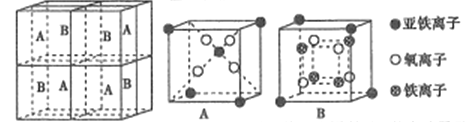
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为______(填最简整数比);已知该晶体的密度dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数为______nm(用含d和NA的代数式表示)。
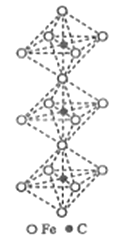
(6)一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心。每个铁原子又为两个八面体共用。则该化合物的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应: I2(g)+H2(g)![]() 2HI(g)(正反应吸热)
2HI(g)(正反应吸热)
起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”“减小”或“不变”)填入相应的表格。
编号 | 反应条件 | 反应速率 |
(1) | 升高温度 | _________ |
(2) | 加入催化剂 | ________ |
(3) | 再充入a mol H2 | ________ |
(4) | 将容器容积扩大为原来2倍 | ________ |
(5) | 通入b mol Ne(g) | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________
(2)烧杯间填满碎纸条的作用是__________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____(填“偏大”、“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”)
(5)用50 mL 0.50 mol·L-1 CH3COOH溶液(已知CH3COOH电离时吸热)进行上述实验,测得的中和热的数值会________。(均填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
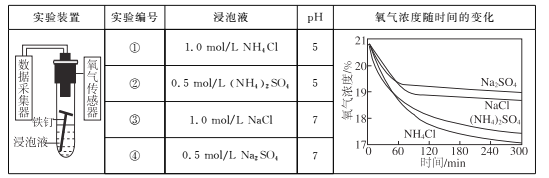
下列说法不正确的是
A. 上述正极反应均为O2+4e-+2H2O=4OH-
B. 在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素
C. 向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D. 在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)、碲(Te)为VIA族元素,是当今高新技术新材料的主要成分之一,电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se和少量金属单质及其他化合物,工业上从其中回收碲、硒的一种工艺流程如下:

已知:
I.Se 单质难溶于水。TeO2微溶于水,易溶于较浓的强酸和强碱;
II.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
III.25℃时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。
(1)Se的氢化物的电子式是_______________。0.1mol/L的H2TeO3电离度(当弱电解质在溶液里达到电离平衡时,溶液中已经电离的电解质分子数占原来总分子数的百分数叫做电离度) 约为_____________________。
(2) 加入浓硫酸焙烧前常将阳极泥中大块颗粒先粉碎,其目的是_______________________。
(3) SeO2 与SO2在冷却后通入水中反应的化学方程式_________________________________。反应后分离出Se单质的操作①为_________________(填操作名称)。
(4)焙砂中碲以TeO2形式存在,与足量NaOH溶液反应后得到的溶液①,其溶质的主要成分为_______(填化学式,过量的NaOH除外)。工业上也可以通过电解溶液①得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为__________________________________。
(5)向溶液①中加入硫酸时控制溶液的pH 为4.5~5.0,生成TeO2沉淀,如果H2SO4过量,将导致碲的回收率__________(填“偏高”、“偏低”或“无影响”)。
(6)将纯净的TeO2先溶于盐酸得到四氯化碲,然后再将SO2通入到溶液中得到Te单质,请写出由四氯化碲得到Te单质的离子方程式________________________________。
(7)上述流程中可循环利用的物质_______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年世界军运会在武汉举办,开幕式上,主力炬在水中点燃后呈现水火交融的景象,惊艳世界。主火炬中的燃料是天然气,下列说法不正确的是( )
A.天然气易溶于水B.天然气的主要成分是甲烷
C.火炬燃烧涉及化学变化D.天然气燃烧的主要产物是CO2和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com