

| ||
| ||
| 120 |
| 1×36%×65% |
| 2×98 |
| 98%x |


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
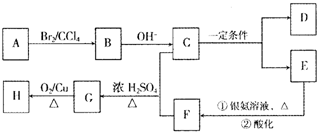
期末集结号系列答案科目:高中化学 来源: 题型:
| A、18O2和16O2是两种不同的核素 |
| B、将a克铜丝灼烧成黑色后趁热插入乙醇中,铜丝变红,质量小于a克 |
| C、N4分子为正方形结构,每个分子中含有6个共价键 |
| D、2N5=5N2是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (R、R′可以是烃基也可以是氢原子)
(R、R′可以是烃基也可以是氢原子)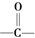 的异构体共有个
的异构体共有个查看答案和解析>>
科目:高中化学 来源: 题型:
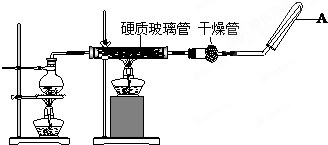
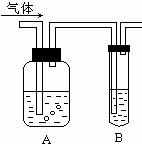 如图把气体缓慢通过盛有足量试剂的试剂瓶A,试管B不能观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,试管B不能观察到明显现象的是( )| 选项 | 气体 | A中试剂 | B中试剂 |
| A | SO2、CO2 | 酸性KMnO4溶液 | 澄清石灰水 |
| B | Cl2、HCl | 饱和NaCl溶液 | KI淀粉溶液 |
| C | NH3、CO2 | 浓硫酸 | 酚酞试液 |
| D | CO2、HCl | 饱和NaHCO3溶液 | NaAlO2溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
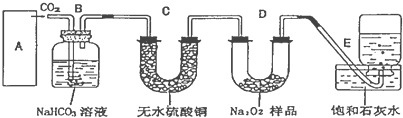
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、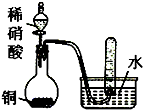 验证铜与稀硝酸的反应产物是NO |
B、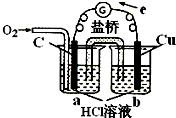 实现化学反应:2Cu+O2+4H+=2Cu2++2H2O |
C、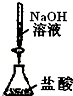 测定盐酸的浓度 |
D、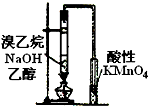 检验溴乙烷与NaOH醇溶液共热有乙烯生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com