

| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
分析 铝灰(含Al2O3及少量SiO2和FeO•xFe2O3),加入过量稀硫酸酸溶过滤,滤液为硫酸铝、硫酸亚铁、硫酸铁,滤渣为二氧化硅和不溶性杂质,滤液中加入稍过量的高锰酸钾溶液氧化亚铁离子为铁离子,调节溶液PH使铁离子全部沉淀,铝离子不沉淀,加入适量硫酸锰除去过量的高锰酸钾过滤得到二氧化锰固体和氢氧化铁沉淀,滤液主要是硫酸铝溶液,蒸发浓缩,冷却结晶过滤洗涤得到硫酸铝晶体,
(1)氧化铝是两性氧化物溶于强酸强碱,与硫酸反应生成硫酸铝和水;
(2)亚铁离子、铁离子同时存在,可用酸性高锰酸钾溶液检验亚铁离子;
(3)一定条件下,MnO4-可与Mn2+反应生成MnO2;
①依据金属阳离子沉淀开始和完全沉淀需要的溶液pH分析,亚铁离子被氧化为铁离子,调节溶液pH使铁离子全部沉淀;
②浓盐酸和二氧化锰再加热条件下生成黄绿色气体氯气;
③加入MnSO4至紫红色消失,目的是除去过量高锰酸根离子;
(4)由元素守恒可知,母液中存在较多的K+、SO42-.
解答 解:向铝灰中加入过量稀H2SO4,A12O3和少量FeO•xFe2O3和硫酸反应生成硫酸铝、硫酸铁、硫酸亚铁,SiO2不反应,过滤除去二氧化硅;向滤液中加入过量KMnO4溶液,高锰酸钾把亚铁离子氧化成铁离子,调节溶液的pH约为3.7生成氢氧化铁沉淀,除去铁离子,过滤,滤液中含铝离子和过量的高锰酸根离子,加入硫酸锰把过量高锰酸根离子除去,再过滤,对滤液蒸发浓缩、结晶分离出硫酸铝晶体,
(1)硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O;
(2)由于铁离子和亚铁离子同时存在,所以检验亚铁离子应该用酸性高锰酸钾溶液,方法为:取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色,
故答案为:取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色;
(3)①向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子;
依据图表数据分析可知,铁离子开始沉淀和沉淀完全的溶液PH为2.7~3.2,铝离子和亚铁离子开始沉淀的溶液pH大于3.2,所以调节溶液的pH约为3.2,可以使铁离子全部沉淀,铝离子不沉淀分离,
故答案为:将Fe2+氧化为Fe3+;调节pH值使铁元素沉淀完全;
②向Ⅱ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,生成氯化锰、氯气和水,生成的氯气是黄绿色气体,能说明沉淀中存在MnO2的现象是生成黄绿色气体,
故答案为:有黄绿色气体生成;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
③MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去,
故答案为:除去过量的MnO4-;
(4)反应后,溶液中存在较多的K+、SO42-便留在母液中,可回收的主要物质为K2SO4,
故答案为:K2SO4.
点评 本题考查了物质的制备流程分析,题目难度中等,涉及铝、铁及其化合物性质的应用,主要是混合物分离的方法和实验设计,加入氧化剂氧化亚铁离子,调节溶液PH是沉淀分离是解题的关键,试题充分考查了学生的分析、理解能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 如图是M、N两种不含结晶水的固体物质溶解度曲线.下列说法中正确的是( )
如图是M、N两种不含结晶水的固体物质溶解度曲线.下列说法中正确的是( )| A. | t1℃时,N比M的溶解度大 | |
| B. | 温度从t1℃升高到t3℃时,N的饱和溶液张溶质的质量分数将增大 | |
| C. | M比N的溶解度大 | |
| D. | N中含有少量M时,可用降温结晶法提纯N |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
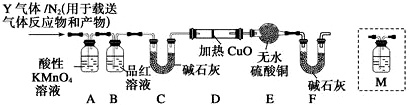
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=3的溶液中:Na+、NO3-、Cl-、Al3+ | |
| B. | 使pH试纸呈红色的溶液中:Fe2+、ClO-、SO42-、Na+ | |
| C. | 由水电离出的c(H+)=10-13 mol•L-1的溶液中:CO32-、SO42-、Cl-、Na+ | |
| D. | 加入铝粉后产生大量氢气的溶液中:NH4+、Na+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅有②④⑥ | B. | 仅有①⑤⑦⑨⑩ | C. | 仅有②③④ | D. | 仅有①⑤⑥⑦⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
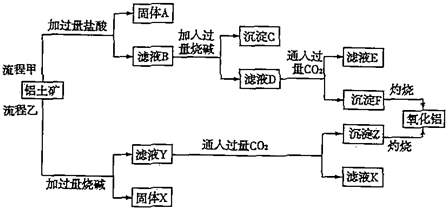
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因 | |
| B. | 水分解生成氢气跟氧气的同时吸收能量 | |
| C. | 1mol H2跟$\frac{1}{2}$mol O2反应生成1mol H2O释放能量一定为245kJ | |
| D. | 为开发氢能,可研究设法将太阳能聚焦,产生高温使水分解产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性X>Y>Z | |
| B. | X、Y、Z形成的阴离子还原性逐渐增强 | |
| C. | 原子半径X<Y<Z | |
| D. | X、Y、Z的气态氢化物稳定性由弱到强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com