
下列根据实验操作和现象所得出的结论正确的是:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 洁净的铁钉在浓硝酸中浸泡片刻,蒸馏水冲洗后,再放入CuSO4溶液 | 铁钉表面无红色物质生成 | 铁钉在浓硝酸中已钝化 |
| B | 向溶液X中先滴加稀NaOH溶液,再将湿润红色石蕊试纸置于试管口附近 | 试纸不变蓝 | 原溶液X中肯定无NH4+ |
| C | 向PbO2中滴入浓盐酸 | 有黄绿色气体 | PbO2具有还原性 |
| D | 向溶液X 中先滴加氯水,再滴加KSCN溶液 | 溶液变红 | 溶液X中一定含有Fe2+ |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:阅读理解

| 操 作 | 现 象 |
| 点燃酒精灯, 加热至170℃ |
Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕, 清洗烧瓶 |
Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |


| 设 计 | 现 象 | |
| 甲 | 在A、B间增加一个装有某种试剂的洗气瓶 | Br2的CCl4溶液褪色 |
乙 |
与A连接的装置如下: |
D中溶液由红棕色变为浅红棕色时,E中溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省清远市高三上学期期末检测理综化学试卷(解析版) 题型:实验题
阿司匹林是一种历史悠久的解热镇痛药,学名为乙酰水杨酸,结构简式为 。某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
。某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
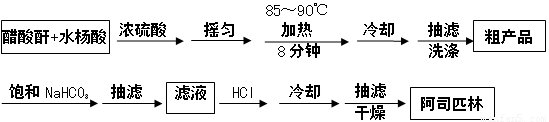
已知:1、乙酰水杨酸是白色晶体,易溶于乙醇、乙醚,在128~135℃易分解。
2、主要试剂和产品的其它物理常数
|
名称 |
相对分子质量 |
熔点或沸点(℃) |
水溶性 |
|
水杨酸 |
132 |
158(熔点) |
微溶 |
|
醋酸酐 |
102 |
139.4(沸点) |
与水反应 |
|
乙酰水杨酸 |
180 |
135(熔点) |
微溶 |
请根据以上信息回答下列问题:
(1)写出水杨酸与醋酸酐制备阿司匹林的化学方程式 。
(2)制备阿司匹林主反应时,仪器必须干燥的原因是 。
(3)合成阿司匹林主反应时,最合适的加热方法是 ,除酒精灯外,该加热装置还需要的玻璃仪器有 。
(4)提纯粗产品时加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤(即减压过滤),结合提纯流程回答加饱和NaHCO3溶液的目的是 。
(5)最终所得产品可能仍含有少量水杨酸,检验含有水杨酸的操作和现象是
。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省内江市高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
某研究小组探究:
I .铜片和浓硫酸的反应(夹持装置和A中加热装置已略,气密性已检验)
II. SO2 和 Fe( NO3)3 溶液的反应[1.0 mol/L 的 Fe(NO3)3 溶液的 pH=1] 请回答下列有关问题:
探究I
(l)某学进行了下列实验:取12.8g铜片和20 mL 18 mol•L-1的浓硫酸放在三颈瓶中共热,直至反应 完毕,最后发现烧瓶中还有铜片剩余,同时根据所学的知识同学们认为还有较多的硫酸剩余。

①装置A中反应的化学方程式是_______
②该同学设计求余酸浓度的实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是______ (填字母)。
A.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称貴
B.将产生的气体缓缓通入酸性髙锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定其产生气体的体积(折算成标准状况)
D.用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况)
探究II
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是______。
(3)裝置B中产生了白色沉淀,分析B中产生白色沉淀的原因,提出下列三种猜想:
猜想1:SO2与Fe3+反应;猜想2 :在酸性条件下SO2与NO3-反应;猜想3:____________;
①按猜想1,装置B中反应的离子方程式是______,证明该猜想应进一步确认生成的新物质,其实验操作及现象是____________。
②按猜想2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列某种溶液,在相同条件下进行实验。应选择的替换溶液是______ (填序号)。
a.0.1 mol/L 稀硝酸 b. 1.5 mol/L Fe(NO3)2 溶液
c. 6.0 mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省盐城中学高二(上)期中化学试卷(必修)(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com