
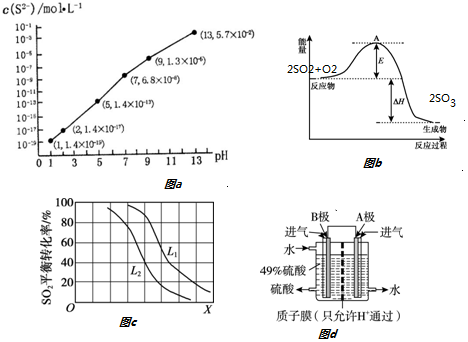
���� ��1����pH=13ʱ��c��S2-��=5.7��10-2mol/L����0.10mol•L-1H2S��Һ�и������غ�c��H2S��+c��HS-��+c��S2-��=0.10mol•L-1��
�ڵ�Qc=Ksp��MnS��ʱ��ʼ�������ɴ���������ӵ�Ũ�ȣ����ͼ��ó���ʱ��pH������MnS��FeS��Ksp���㣻
��2����ͼ�������Ӧ�ʱ���2mol����������ȫ��Ӧ����������EΪ��ܣ���ܵĴ�С�뷴Ӧ���أ���������ܽ��ͷ�Ӧ�Ļ�ܣ�
�ڼ����ʱ��Ӧ��Ũ����Q����ƽ�ⳣ���Ƚ��жϷ�Ӧ���еķ���
�۸÷�ӦΪ���������С�ķ�Ӧ���������ѹǿ��ת���ʴ�Ӧ�Ƿ��ȷ�Ӧ������ƽ��������У���������ת���ʼ�С���ݴ��жϣ�
��3���ٸ�ԭ����У�������ʧ���ӱ����������Ը�����Ͷ�ŵ������Ƕ�������������ʧ���Ӻ�ˮ��Ӧ������������Ӻ������ӣ�������Ͷ�ŵ������������������������õ��Ӻ������ӷ�Ӧ����ˮ�����������ˮ�ij��ڷ���֪��B���Ǹ�����A����������
��B���ϵĵ缫��Ӧ��������ʧ���Ӻ�ˮ��Ӧ������������Ӻ������ӣ�
��� �⣺��1���ٸ�����ҺpH��c��S2-����ϵͼpH=13ʱ��c��S2-��=5.7��10-2mol/L����0.10mol•L-1H2S��Һ�и������غ�c��H2S��+c��HS-��+c��S2-��=0.10mol•L-1������c��H2S��+c��HS-��=0.1-5.7��10-2=0.043mol/L��
�ʴ�Ϊ��0.043��
�ڵ�Qc=Ksp��FeS��ʱ��ʼ����������c��S2-��=$\frac{Ksp��FeS��}{c��F{e}^{2+}��}$=$\frac{1.4��1{0}^{-19}}{0.01}$mol/L=1.4��10-17mol/L�����ͼ��ó���ʱ��pH=2������pH=2ʱ�������ӿ�ʼ������
��Һ��$\frac{c��M{n}^{2+}��}{c��F{e}^{2+}��}$=$\frac{Ksp��MnS��}{Ksp��FeS��}$=$\frac{2.8��1{0}^{-13}}{1.4��1{0}^{-19}}$mol/L=2��106��
�ʴ�Ϊ��2��2��106��
��2��SO2��g��+$\frac{1}{2}$O2��g��?SO3��g����H=-99kJ/mol��
��ͼ�������֪2molSO2������ȫ����Ӧ����Ӧ�ʱ��H=-99kJ/mol��2mol=-198KJ��EΪ��ܣ���Ӧ�ȿɱ�ʾΪA��C��ܵĴ�С֮���ܵĴ�С�뷴Ӧ���أ���������ı��˷�Ӧ��;�������ͷ�Ӧ����Ļ�ܣ�����E�ı仯�Ǽ�С��
�ʴ�Ϊ��-198����Ϊ�����ı��˷�Ӧ������ʹ���E���ͣ�
�ڸ��¶��£���100L�ĺ����ܱ������У�����3.0mol SO2��g����16.0mol O2��g����3.0mol SO3��g����Ũ����Qc=$\frac{\frac{3.0mol}{100L}}{\frac{3.0mol}{100L}����\frac{16.0mol}{100}��^{\frac{1}{2}}}$=2.5��K=$\frac{10}{3}$��
��Ӧ��ʼʱ��������v���棩
�ʴ�Ϊ������
����ͼ��֪��XԽ��ת����Խ�ͣ��÷�Ӧ����ӦΪ���������С�ķ�Ӧ���������ѹǿ��������̼��ת���ʴ�����X��ʾ�¶ȣ��¶����ߣ�ת�����½���ƽ�������ƶ�������ѹǿ��ת���ʴ�����L1��L2��
�ʴ�Ϊ���¶ȣ�L1��L2��2SO2+O2$\frac{\underline{\;����\;}}{\;}$2SO3��Ӧ�ġ�H=-198 kJ/mol���Ƿ��ȷ�Ӧ����ѹǿһ��ʱ���¶����ߣ�ƽ�����ƣ�SO2ƽ��ת���ʼ�С��
��3���ٸ�ԭ����У�������ʧ���ӱ����������Ը�����Ͷ�ŵ������Ƕ�������������ʧ���Ӻ�ˮ��Ӧ������������Ӻ������ӣ�������Ͷ�ŵ������������������������õ��Ӻ������ӷ�Ӧ����ˮ�����������ˮ�ij��ڷ���֪��B���Ǹ�����A����������
�ʴ�Ϊ��������
�ڷ�����֪B���ϵĵ缫��ӦʽΪ��SO2-2e-+2H2O�TSO42-+4H+��
�ʴ�Ϊ��SO2-2e-+2H2O�TSO42-+4H+��
���� ���⿼�黯ѧƽ�ⳣ����ƽ��״̬���жϡ�ȼ�ϵ�ء�������ԭ��Ӧ���ζ������֪ʶ���漰�������ϴ���Ŀ�Ѷ��еȣ�


 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��˾ƥ������֪�Ľ�����ʹ��ҩ���ѧ��Ϊˮ���� | |
| B�� | ���ڵĴ���ʹ�ð�˾ƥ�ֻ����ˮ�����ж���Ӧͣҩ����ע��Na2CO3��Һ | |
| C�� | ��ù������Ҫ�Ŀ����أ�����һ������������ | |
| D�� | ��Ʒ��ָ��ҽ��Ŀ�Ķ�����ʹ�ò��������Ե�ҩƷ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cl2+NaBr | B�� | Br2+KI | C�� | Br2+KCl | D�� | Cl2+KI |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���¶��£���Ӧ��ƽ�ⳣ����$\frac{1}{64}$ | |
| B�� | 0��2min�ڣ�HI��ƽ����Ӧ����Ϊ0.1mol•L-1•min-1 | |
| C�� | �ں��������£������ϵ�г���HI���壬ƽ�ⲻ�ƶ�����Ӧ���ʲ��� | |
| D�� | �����¶ȣ�ƽ��������Ӧ�����ƶ���ֻ������Ӧ���ʼӿ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ֹ����й����ӡ�����Ǧ���ؽ���Ԫ�ض�������ˮԴ����Ⱦ | |
| B�� | �������е�ʯī�缫 | |
| C�� | ��ʹ�����й�ĵ��Һ��ʴ������Ʒ | |
| D�� | �������еĸ��ֽ��������ϰ�װ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H=-2 878 kJ•mol-1 | B�� | ��H=-2 658 kJ•mol-1 | ||
| C�� | ��H=-1 746 kJ•mol-1 | D�� | ��H=-1 526 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �� | B�� | �� | C�� | �� | D�� | �� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com