
下列溶液中各微粒的浓度关系或说法错误的是
A.0.1 mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
B.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3、(NH4)2Fe(SO4)2溶液和NH4Cl溶液
c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
C.0.1 mol•L-1 NaHCO3溶液中:c(OH-)=c(H+)-c(CO32-)+c(H2CO3)
D.向0.2 mol•L-1的CH3COOH和0.1 mol•L-1的NaOH等体积混合溶液中,加入少量的NaOH或HCl溶液时,溶液的pH不会发生显著变化
科目:高中化学 来源: 题型:阅读理解
 W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?湖北模拟)X、Y、Z、M、N、K是由短周期元素构成的微粒,其中X、Y、Z是阳离子,M、N是中性分子,K是阴离子,它们具有下列结构特点和性质:
(2011?湖北模拟)X、Y、Z、M、N、K是由短周期元素构成的微粒,其中X、Y、Z是阳离子,M、N是中性分子,K是阴离子,它们具有下列结构特点和性质:

查看答案和解析>>
科目:高中化学 来源:福建省厦门一中2010-2011学年高二下学期期中考试化学试题 题型:022
由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种是离子,且每个微粒中都含有10个电子.已知A、E是由非金属元素组成的阳离子,六种微粒间有下列关系:
①A、B两种离子在加热条件下可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1 mol B离子与1 mol E离子作用可生成2 mol D分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解.
(1)微粒A的化学式是________;微粒E的名称是________.构成微粒F的元素在元素周期表中的位置是________.
(2)写出F与过量C溶液反应的离子方程式:________.
(3)六种微粒中的两种可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加人浓苛性钠溶液,产生的现象有:a.溶液中出现白色沉淀;b.有刺激性气味气体放出;c.沉淀逐渐增多;d.沉淀完全消失;e.沉淀逐渐减少.
①该复盐在溶液中的电离方程式是________.
②上述各实验现象由先到后出现的正确顺序是(填写序号)________.
查看答案和解析>>
科目:高中化学 来源:2011届湖北省八校高三第一次联考(理综)化学部分 题型:填空题
X、Y、Z、M、N、K是由短周期元素构成的微粒,其中X、Y、Z是阳离子,M、N是中性分子,K是阴离子,它们具有下列结构特点和性质:
①它们核外电子总数都相同; ②N溶于M中,滴入酚酞,溶液变红;
③X和N都由A、C两元素组成,X和Y核内质子数相等;
④Y和K都由A、B两元素组成,Y核内质子总数比K多两个;
⑤Z为单核离子,且离子半径是与其具有相同电子层结构离子中半径最小的。
根据以上信息,请回答下列问题:
(1)Y的化学式为 ,X的电子式为 。
(2)试比较M和N的稳定性:M N(填“>”、“<”、“=”)
(3)检验X的方法是 。
(4)由A、B、C三种元素组成的物质中,属于离子化合物的有 ,属于共价化合物的有 (各任写一种物质的化学式)
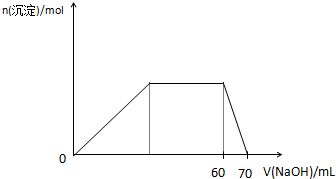
(5)上述六种微粒中的两种可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入0.1mol/L氢氧化钠溶液,随着氢氧化钠溶液的加入,产生沉淀的关系如下图,则该复盐的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2011届江西省赣州市高三下学期十一县市期中联考(理综)化学部分 题型:填空题
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W最外层电子数与电子层数相同,Y与X相邻,Y与Z也相邻;元素Z在地壳中含量最高。试回答下列各题:
(1)写出由其中两种元素组成的盐的电子式 。
(2)比较Y、Z离子半径大小 ( 用化学式表示)
(3)已知W、Y、Z三种元素两两组合,可组成多种10电子微粒,请写出反应物生成物均为10电子微粒的离子方程式_______________________________________。
(4)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A是日常生活中常用调味品的主要成分,且A与B能够反应生成C,C是一种有香味的液体。试写出该反应的化学方程式____________________________________________。
(5)由W、X、Y、Z四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式_________________________。
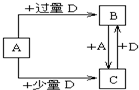
(6)已知由元素X和Z可组成A、B、C、D四种中学化学中常见的单质或化合物,四种物质之间存在如图所示的转化关系。
①写出A与B反应生成C的化学方程式____________________________________;
②向50 mL4 mol·L-1的NaOH溶液中通入1.12 L B(标准状况),反应后溶液中溶质的物质的量之比为__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com