
【题目】有关下图所示化合物的说法不正确的是 ( ) 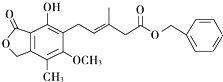
A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B.1mol该化合物最多可以与3molNaOH反应
C.既可以催化加氢,又可以使酸性KMnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
科目:高中化学 来源: 题型:
【题目】下列对实验操作及结论的描述不正确的是( )
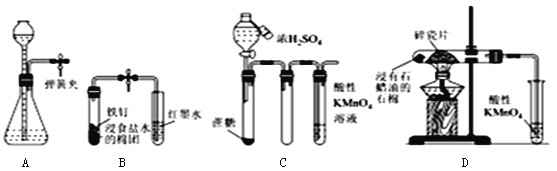
A. 夹紧弹簧夹,由长颈漏斗加水至产生液面差,一段时间后液面差不变,说明气密性良好
B. 打开弹簧夹,红墨水倒吸入导气管中,说明铁钉发生了吸氧腐蚀
C. 滴加浓硫酸后,高锰酸钾溶液褪色,说明浓硫酸使蔗糖脱水的同时还产生了二氧化硫
D. 加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种具有耐高温等优异性能的新型陶瓷.工业上可用下列方法制取:3SiO2+6C+2N2 ![]() Si3N4+6CO.下列说法正确的是( )
Si3N4+6CO.下列说法正确的是( )
A.氮化硅晶体属于分子晶体
B.氮化硅中氮元素的化合价为﹣3
C.上述反应中,N2是还原剂,SiO2是氧化剂
D.上述反应中,每生成1mol Si3N4 , N2得到6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CO(g)=2C(s)+O2(g)的△H为正值,△S为负值.设△H和△S不随温度改变,下列说法中正确的是( )
A.低温下能自发进行
B.高温下能自发进行
C.低温下不能自发进行,高温下能自发进行
D.任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取Al可采用如图所示工艺流程:
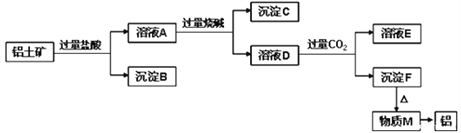
请回答下列问题:
(1)铝土矿加入盐酸后生成Al3+的离子方程式为_____________________________。
(2)沉淀B与烧碱反应的离子方程式为______________________________________。
(3)溶液D中通入过量CO2的离子方程式为_____________________________。
(4)“通入过量CO2”能否改用过量盐酸________(填“能或否”),原因是_____________。
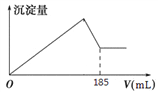
(5)向共含有0.05mol Al3+、Fe3+的溶液中滴入1mol/L NaOH 溶液,生成沉淀的量与加入NaOH 溶液的体积关系如图所示。 则溶液中Al3+的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示. 
请回答下列问题:
(1)碘是物质,实验室常用方法来分离提纯含有少量杂质的固体碘.
(2)写出碘酸钾在酸性介质中与过氧化氢反应的离子方程式:
(3)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.图中的序号3应为离子交换膜(填“阳”或“阴”);电解时,阳极上发生反应的电极反应式为 .
(4)教材中利用KI与空气的反应来探究反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2SO4溶液、淀粉溶液,则实验时这几种试剂的加入顺序为:KI溶液、、;反应的离子方程式为 .
(5)已知KI+I2KI3 , 将I2溶于KI溶液,在低温条件下,可制得KI3H2O.该物质作为食盐加碘剂是否合适?(填“是”或“否”),并说明理由 . 为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 . A.Na2S2O3B.AlCl3C.Na2CO3D.NaNO2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列5个有机化合物中,能够发生酯化、加成和氧化3种反应的是( )
①CH2=CHCOOH
②CH2=CHCOOCH3
③CH2=CHCH2OH
④CH3CH2CH2OH
⑤ ![]()
A.①③④
B.②④⑤
C.①③⑤
D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学方程式的书写.
(1)硝基苯的制备:
(2)2﹣甲基﹣2﹣溴丁烷的水解反应:
(3)聚苯乙烯的制备:
(4)1﹣丙醇的消去反应:
(5)甲醛的银镜反应:
(6)乙醛与新制氢氧化铜的反应:
(7)乙酸甲酯碱性水解反应:
(8)氯乙烷的消去反应: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4 ![]() HC2O4-+ H+ Ka 1 ; HC2O4-
HC2O4-+ H+ Ka 1 ; HC2O4- ![]() C2O42-+ H + Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
C2O42-+ H + Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
A.常温下,Ka1 :Ka2 =1000
B.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得 pH为4.2的混合液
C.pH=1.2 溶液中:c(K + ) + c(H + ) = c(OH-) + c(H2C2O4)
D.向 pH=1.2 的溶液中加 KOH 溶液将pH增大至4.2的过程中水的电离度一直增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com