

| c(NaOH)V(NaOH) |
| 2V(H2SO4) |
| 35.65mL+35.55mL |
| 2 |
| 1000×1.98×98% |
| 98×1 |
| 35.60×5.00 |
| 2×5.00 |
| 35.65mL+35.55mL |
| 2 |
| 1000×1.98×98% |
| 98×1 |
| 35.60×5.00 |
| 2×5.00 |
| 35.65mL+35.55mL |
| 2 |
| 1000×1.98×98% |
| 98×1 |
| 35.60×5.00 |
| 2×5.00 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
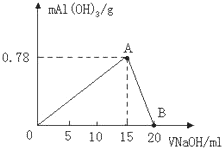 向20mL某物质的量浓度的AlCl3溶液中滴入2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所加NaOH溶液体积(mL)的关系如图所示,试回答下列问题:
向20mL某物质的量浓度的AlCl3溶液中滴入2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所加NaOH溶液体积(mL)的关系如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
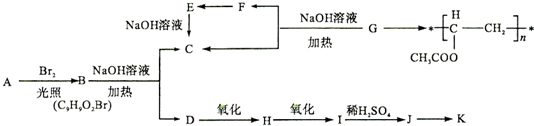
查看答案和解析>>
科目:高中化学 来源: 题型:
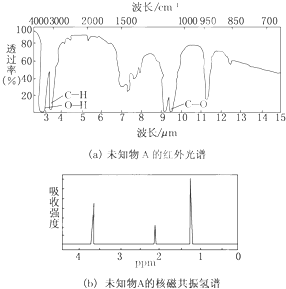
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
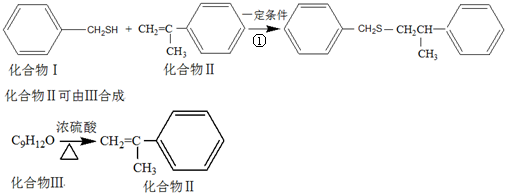
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去氯化钠固体中少量的纯碱:加入足量氯化钙,过滤、蒸发、结晶 |
| B、用溴水鉴别苯、乙醇、四氯化碳 |
| C、在淀粉中加入稀硫酸,加热一段时间后,先加NaOH溶液,再加银氨溶液检验葡萄糖的存在 |
| D、用溴水验证裂化汽油中含有不饱和烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.8 | B、11.6 |
| C、18.8 | D、23.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com