
| 酸 | 碱 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 盐酸 | 纯碱 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | 硫酸 | 烧碱 | 食盐 | 氧化钙 | 一氧化碳 |
| C | 醋酸 | 苛性碱 | 小苏打 | 一氧化碳 | 二氧化硫 |
| D | 硫酸 | 苛性钾 | 苏打 | 氧化铜 | 三氧化硫 |
| A. | A | B. | B | C. | C | D. | D |
分析 酸是指电离时生成的阳离子全部是氢离子的化合物;
碱是指电离时生成的阴离子全部是氢氧根离子的化合物;
盐是指由金属离子(或铵根离子)和酸根离子组成的化合物;
碱性氧化物是和酸反应生成盐和水的氧化物;
酸性氧化物是和碱反应生成盐和水的氧化物.
根据以上概念分析.
解答 解:A、盐酸属于酸;纯碱为碳酸钠,属于盐;烧碱为氢氧化钠,属于碱;氧化铝属于两性氧化物;二氧化碳属于酸性氧化物,故A错误;
B、硫酸属于酸;烧碱为氢氧化钠,属于碱;食盐为氯化钠,属于盐;氧化钙属于碱性氧化物;一氧化碳属于不成盐氧化物,不是酸性氧化物,故B错误;
C、醋酸属于酸;苛性碱一般是指氢氧化钠和氢氧化钾,属于碱;小苏打为碳酸氢钠,属于盐;一氧化碳属于不成盐氧化物,不是碱性氧化物;二氧化硫属于酸性氧化物,故C错误;
D、硫酸属于酸;苛性钾为氢氧化钾,属于碱;苏打为碳酸钠,属于盐;氧化铜属于碱性氧化物;三氧化硫属于酸性氧化物,故D正确;
故选:D.
点评 本题考查了物质分类方法和概念实质理解应用,掌握基础是关键,题目较简单.


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCO2所含的原子数为1.5NA | |
| B. | 常温常压下,48gO2与O3混合物含有的氧原子数为3NA | |
| C. | 标准状况下,22.4LCCl4中所含分子数为NA | |
| D. | 标准状况下,18g水所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
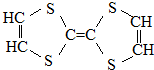
| A. | 它属于烃的衍生物 | B. | 所有的碳杂化方式相同 | ||
| C. | 属于高分子化合物 | D. | 它可以与氢气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①④⑥ | C. | ①③④ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-丁烯不存在顺反异构体 | |
| B. | 已知丙烷的二氯代物有四种异构体,则其六氯代物的异构体数目为六种 | |
| C. | 菲的结构简式为 ,它与硝酸反应,可生成4种一硝基取代物 ,它与硝酸反应,可生成4种一硝基取代物 | |
| D. | 乙醇的核磁共振氢谱中有三个峰,峰面积之比是l:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
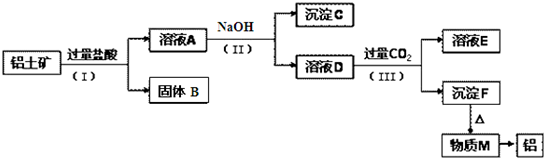
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质(括号中为杂志) | 所加试剂 | 操作方法 |
| 酒精(水) | 新制生石灰 | 蒸馏 |
苯甲酸(沙子) | / | 过滤 |
| 甲烷(乙烯) | 溴水(溴的四氯化碳溶液) | 洗气 |
| 溴苯(溴) | 氢氧化钠溶液 | 分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com