
分析 (1)根据1mol CH4完全燃烧生成CO2和液态H2O,放出890.3kJ的热量判断;
(2)根据1mol CH4完全燃烧生成CO2和液态H2O,放出890.3kJ的热量计算;
(3)根据燃烧热的定义为1mol可燃物完全燃烧生成稳定的化合物放出的热量书写.
解答 解:(1)因为1mol CH4完全燃烧生成CO2和液态H2O,放出890.3kJ的热量,所以CH4的燃烧热△H=-890.3 kJ•mol-1;故答案为:-890.3 kJ•mol-1;
(2)因为1mol CH4完全燃烧生成CO2和液态H2O,放出890.3kJ的热量,所以44.8L CH4(标准状况)燃烧后所产生的热量为$\frac{44.8L}{22.4L/mol}$×890.3kJ=1780.6 KJ;故答案为:1780.6 KJ;
(3)丙烷的燃烧热是-2219.9kJ/mol,所以丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2 219.9 kJ/mol,故答案为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2 219.9 kJ/mol.
点评 本题考查了对燃烧热概念的理解应用,掌握基础是关键,题目较简单.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:实验题
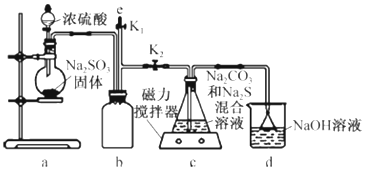
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | ① | ② | ③ | ④ |
| m(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| m(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-1/2(4x-y)kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(8x-2y)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯和氯气光照--取代 | |
| B. | 乙烯和溴水的反应--氧化 | |
| C. | 乙烯使酸性高锰酸钾溶液褪色--加成 | |
| D. | 乙烯水化法制乙醇--取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCO2含有6.02×1023个原子 | |
| B. | 1molNa2CO3的质量为106g | |
| C. | Na+的摩尔质量等于23g/mol | |
| D. | 0.012kg12C中碳原子数约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a:Fe b:FeCl3 c:FeCl2 | B. | a:AlCl3 b:Al(OH)3 c:Al2O3 | ||
| C. | a:N2 b:NH3 c:NO2 | D. | a:SO2 b:SO3 c:H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

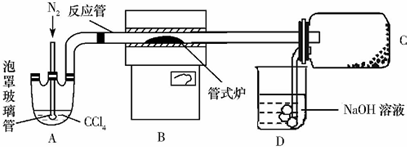
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com