
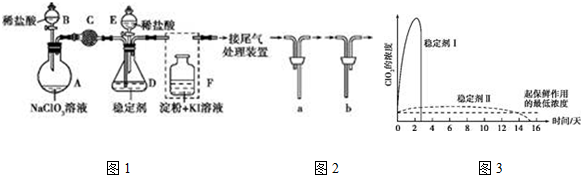
分析 装置A中盛放NaClO3溶液,装置B盛放稀盐酸,两者发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,装置C的作用是吸收Cl2,除去氯气,ClO2在装置D中被稳定剂完全吸收生成NaClO2,在酸性条件下NaClO2可发生反应4H++5ClO2-=Cl-+4ClO2↑+2H2O生成NaCl并释放出ClO2,装置F检验二氧化氯中氯气是否完全被装置C吸收,
(1)根据仪器特征,可知仪器D是锥形瓶;F装置应是Cl2和KI反应,还需要连接尾气处理装置;
(2)为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢,控制液体的滴加速率;
(3)而F中溶液的颜色不变,说明Cl2被C装置吸收;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成;
(5)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
解答 解:(1)根据仪器特征,可知仪器D是锥形瓶;F装置应是Cl2和KI反应,还需要连接尾气处理装置,所以应长管进气,短管出气,故选b,
故答案为:锥形瓶;b;
(2)为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢,故滴加稀盐酸的速度要慢,
故答案为:慢;
(3)F装置中发生Cl2+2KI=2KCl+I2时,碘遇淀粉变蓝,而F中溶液的颜色不变,则装置C的作用是吸收Cl2,
故答案为:吸收Cl2;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为:4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成,
故答案为:4H++5ClO2-=Cl-+4ClO2↑+2H2O;验证是否有ClO2 生成;
(5)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好,
故答案为:稳定剂Ⅱ;稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
点评 本题以ClO2的制备、吸收、释放为载体,考查实验制备方案设计、基本操作、对装置及操作的分析评价等,注意根据问题进行制备流程分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中分子间作用力越大,分子越稳定 | |
| B. | 二氧化硅的熔点、硬度均比二氧化碳高 | |
| C. | 冰融化时水分子时,仅共价键发生断裂,分子本身没有变化 | |
| D. | 氯化钠熔化时离子键被破坏,故属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜器出现铜绿 | B. | 过氧化钠作供氧剂 | ||
| C. | 大理石雕像被酸雨腐蚀毁坏 | D. | 铝锅表面牛成致密的薄膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 水 | 四氯化碳 | |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 |
| A.证明Fe3+与SO2发生了氧化还原反应 | 将过量SO2通入FeCl3溶液中,然后将反应液加入酸性高锰酸钾溶液中,发现高锰酸钾溶液褪色 |
| B.除去CH3COOC2H5中的乙醇 | 加入适量CH3COOH,加热 |
| C.比较AgCl和AgI的 Ksp大小 | 向10mL浓度均为0.01mol/L的NaCl和KI混合溶液滴加少量0.01mol/L AgNO3溶液,观察现象 |
| D.比较H2CO3、HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液的pH值,比较pH大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com