
【题目】下表中对应关系错误的是( )
A | NaCl=Na++Cl-; NH3·H2O | 均属于电离方程式 |
B | Ba2++SO HCO | 均可表示一类反应 |
C | SO2使酸性高锰酸钾溶液褪色; SO2使碱性酚酞溶液褪色 | 均利用SO2的同一性质 |
D | Cl2+2NaOH=NaCl+NaClO+H2O; 3S+6NaOH=2Na2S+Na2SO3+3H2O | Cl2和S在反应中既作氧化剂又作还原剂 |
A.AB.BC.CD.D
【答案】C
【解析】
A.氯化钠电离生成钠离子、氯离子,电离方程式为:NaCl=Na++Cl-,一水合氨属于弱电解质,电离生成氨根离子和氢氧根离子,电离方程式为NH3·H2O![]() NH
NH![]() +OH-,A选项正确;
+OH-,A选项正确;
B.Ba2++SO![]() =BaSO4↓可以表示可溶性钡盐与可溶性硫酸盐反应生成硫酸钡沉淀的反应;HCO
=BaSO4↓可以表示可溶性钡盐与可溶性硫酸盐反应生成硫酸钡沉淀的反应;HCO![]() +OH-=CO
+OH-=CO![]() +H2O表示可溶性碳酸氢盐与可溶性强碱反应生成可溶性碳酸盐和水,均可为复分解反应,B选项正确;
+H2O表示可溶性碳酸氢盐与可溶性强碱反应生成可溶性碳酸盐和水,均可为复分解反应,B选项正确;
C.SO2使酸性高锰酸钾溶液褪色体现其还原性;SO2使碱性酚酞溶液褪色体现其酸性氧化物的性质,C选项错误;
D.Cl2+2NaOH=NaClO+H2O+NaCl,反应中氯元素化合价既升高有降低,氯气既作氧化剂又作还原剂,3S+6NaOH=2Na2S+Na2SO3+3H2O,反应中硫元素化合价既升高有降低,硫既作氧化剂又作还原剂,D选项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为2L的恒容密闭容器中,某一反应中![]() 、
、![]() 、
、![]() 三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
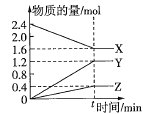
A.反应的化学方程式为![]()
B.t时刻,正、逆反应都不再继续进行,反应达到化学平衡
C.若![]() ,则0~tmin内
,则0~tmin内![]() 的化学反应速率为
的化学反应速率为![]()
D.温度、体积不变,在tmin时充入![]()
![]() 使压强增大,正、逆反应速率都增大
使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物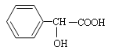 有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发 生显色反应的同分异构体有多少种(不考虑立体异构)
有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发 生显色反应的同分异构体有多少种(不考虑立体异构)
A.6 种B.9 种C.15 种D.19 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸HA是一元弱酸,25℃时的电离平衡常数Ka=4.0×10-8。
(1)写出该酸的电离方程式___,其电离平衡常数表达式Ka=____。
(2)25℃时,向1mol·L-1HA溶液中加入1 mol·L-1 盐酸,会____(“抑制”或“促进”)HA的电离,c(H+)____(填“增大”、“减小”或“不变”), 电离平衡常数Ka___(填“增大”、“减小”或“不变”)。
(3)25℃时,若HA的起始浓度为0.01mol·L-1,则平衡时c(H+)=___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
![]() 向石灰水中通入过量的
向石灰水中通入过量的![]()
![]() 向
向![]() 溶液中通入过量
溶液中通入过量![]()
![]() 向氢氧化铝胶体中逐滴滴入过量稀NaOH溶液
向氢氧化铝胶体中逐滴滴入过量稀NaOH溶液
![]() 向氯化钡溶液中逐渐通入过量二氧化碳
向氯化钡溶液中逐渐通入过量二氧化碳
![]() 向
向![]() 溶液中逐滴滴入过量稀氨水
溶液中逐滴滴入过量稀氨水
![]() 向饱和碳酸钠溶液中逐渐通入过量二氧化碳
向饱和碳酸钠溶液中逐渐通入过量二氧化碳
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如表:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
(1)推导反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:___,判断该反应是____反应(填“吸热”或“放热”)。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:___,判断该反应是____反应(填“吸热”或“放热”)。
II.T1温度下,体积为2L的恒容密闭容器,加入4.00molX,4.00molY,发生化学反应X(g)+Y(g)![]() 2M(g)+N(s) △H<0。
2M(g)+N(s) △H<0。
部分实验数据如下:
t/s | 0 | 500 | 1000 | 1500 |
n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
(2)前500秒,反应速率v(M)=__ ,该反常数应的平衡K=___。
(3)该反应达到平衡时某物理量随温度变化如图所示。纵坐标可以表示的物理量有哪些__。

a.Y的逆反应速率 b.M的体积分数
c.混合气体的密度 d.X的转化率
(4)反应达到平衡后,若再加入2.00molM,1.00molN,下列说法正确的是____。
A.重新达平衡后,用X表示的v(正)比原平衡大
B.重新达平衡后,M的气体体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.25倍
D.重新达平衡后,Y的平均反应速率与原平衡相等
(5)若容器为绝热恒容容器,起始时加入4.00molX,4.00molY,则达平衡后M的物质的量浓度____2mol/L(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O。
(1)Cu2+基态核外电子排布式为__。O的基态电子排布图___。
(2)![]() 的空间构型为___(用文字描述);Cu2+与OH-反应能生成[Cu(OH)4]2-,[Cu(OH)4]2-中的配位原子为__(填元素符号)。
的空间构型为___(用文字描述);Cu2+与OH-反应能生成[Cu(OH)4]2-,[Cu(OH)4]2-中的配位原子为__(填元素符号)。
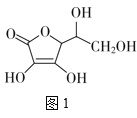
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为__;推测抗坏血酸在水中的溶解性:__(填“难溶于水”或“易溶于水”)。
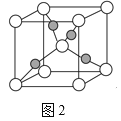
(4)一个Cu2O晶胞(如图2)中,Cu原子的数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示转化关系(X代表卤素),说法不正确的是

A.2H(g) +2X(g) == 2HX(g) ΔH3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3
C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二氮是白色固体,熔点为30℃,升温时易液化和气化,并发生以下两个相互联系的反应:①N2O5(g)![]() N2O3(g)+O2(g)②N2O3(g)
N2O3(g)+O2(g)②N2O3(g)![]() N2O(g)+O2(g)在0.5L密闭容器中,将2.5molN2O5加热气化,并按上述①②两式分解,在某温度下达到平衡,测得O2的平衡浓度为4.4mol/L,N2O3的平衡浓度1.6mol/L,则下列各项判断正确的是( )
N2O(g)+O2(g)在0.5L密闭容器中,将2.5molN2O5加热气化,并按上述①②两式分解,在某温度下达到平衡,测得O2的平衡浓度为4.4mol/L,N2O3的平衡浓度1.6mol/L,则下列各项判断正确的是( )
A.N2O5的转化率为60%
B.平衡时N2O3的物质的量为0.7mol
C.N2O5的平衡浓度为3.0mol/L
D.N2O的平衡浓度为4.4mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com