
| A. | 常温下浓硫酸与铝发生钝化,可在常温下用铝制容器贮运浓硫酸 | |
| B. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| C. | 高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是有强还原性,可消毒杀菌,氧化产物能吸附水中杂质 | |
| D. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 |
分析 A.常温下,浓硫酸和Al发生钝化现象而阻止进一步反应;
B.二氧化硅和HF反应;
C.K2FeO4中Fe元素化合价为+6价,所以 K2FeO4具有强氧化性,还原产物铁离子能水解生成氢氧化铁胶体而作净水剂;
D.原电池中,作负极的金属加速被腐蚀,作正极的金属被保护.
解答 解:A.常温下,浓硫酸和Al发生氧化还原反应生成一层致密的氧化物 薄膜而阻止进一步被氧化,该现象称为钝化现象,所以可在常温下用铝制容器贮运浓硫酸,故A正确;
B.二氧化硅和HF反应生成四氟化硅和水,故B错误;
C.K2FeO4中Fe元素化合价为+6价,所以K2FeO4具有强氧化性,还原产物铁离子能水解生成氢氧化铁胶体,氢氧化铁胶体具有吸附性而作净水剂,故C错误;
D.原电池中,作负极的金属加速被腐蚀,作正极的金属被保护,Fe、Cu和海水构成原电池,Fe易失电子作负极、Cu作正极,所以Fe加速被腐蚀,故D错误;
故选A.
点评 本题考查物质的性质与应用,涉及原电池原理、氧化还原反应、复分解反应、钝化现象等知识点,明确物质的性质即可解答,易错选项是D,铁离子是K2FeO4的还原产物而不是氧化产物.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 玻璃仪器 |
| A | 验证Na2CO3和NaHCO3的热稳定性 | 酒精灯、试管、导气管、烧杯 |
| B | 用碱石灰除去氢气中混有的水蒸气并收集氢气 | 洗气瓶、导气管、集气瓶 |
| C | 用氢氧化钠和醋酸溶液测中和反应的中和热 | 烧杯、玻璃棒、温度计 |
| D | 分离苯和苯酚的混合物 | 分液漏斗、烧杯 |
| A. | A | B. | B | C. | C | D. | .D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是某学生设计的“硫燃烧现象及酸雨危害模拟实验”装置图.实验时操作步骤为:
如图是某学生设计的“硫燃烧现象及酸雨危害模拟实验”装置图.实验时操作步骤为:| A. | 可以观察到,硫在氧气中燃烧发出蓝紫色火焰 | |
| B. | 实验结束时,应用注射器向装置中注入NaOH溶液以便更充分地吸收剩余的SO2气体 | |
| C. | A装置中的注射器的作用相当于分液漏斗,可以随时控制反应的发生和停止 | |
| D. | “酸雨”使绿叶变黄,使锌粒、镁片表面产生气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用15N可以测定亚硝酸盐对地下水质的污染情况.
利用15N可以测定亚硝酸盐对地下水质的污染情况. ,15N2的结构式为15N≡15N;
,15N2的结构式为15N≡15N;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是直链烃,但分子中3个碳原子不在一条直线上 | |
| B. | 在光照条件下能够与氯气发生取代反应 | |
| C. | 丙烷比丁烷易液化 | |
| D. | 1 mol丙烷完全燃烧消耗5 mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2 (g),随温度升高,混合气体的颜色变深.反应的△H大于0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为0.0010mol/(L•s).
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2 (g),随温度升高,混合气体的颜色变深.反应的△H大于0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为0.0010mol/(L•s).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
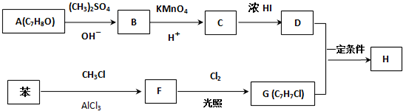

 .
. .
. .
. .
.

 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com