
下列物质的分类不正确的是( )
|
| A. | 水、过氧化氢和干冰都属于氧化物 |
|
| B. | 烧碱、纯碱、熟石灰都属于碱 |
|
| C. | H2SO4、HNO3、H2CO3都属于酸 |
|
| D. | NaHSO4、CuSO4和KMnO4都属于盐 |
考点:
酸、碱、盐、氧化物的概念及其相互联系.
专题:
物质的分类专题.
分析:
依据物质分类分析判断,氧化物是两种元素组成其中一种是氧元素的化合物,水溶液中电离生成的阳离子全部是氢离子的化合物是酸;电离生成的阴离子全部是氢氧根离子的化合物是碱;能电离出金属阳离子(或铵根离子)和酸根离子的化合物是盐.
解答:
解:A、氧化物是两种元素组成其中一种是氧元素的化合物,水(H2O)、过氧化氢(H2O2)和干冰(CO2)都属于氧化物,故A正确;
B、烧碱(NaOH)属于碱、纯碱(Na2CO3)属于盐、熟石灰(Ca(OH)2)属于碱,故B错误;
C、水溶液中电离生成的阳离子全部是氢离子的化合物是酸,H2SO4、HNO3、H2CO3都属于酸,故C正确;
D、能电离出金属阳离子(或铵根离子)和酸根离子的化合物是盐,NaHSO4、CuSO4和KMnO4都属于盐,故D正确;
故选B.
点评:
本题是一道有关物质的分类的题目,熟记各种类型的物质的概念是解题的关键,属于基础知识的考查.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
2006年5月14日某新闻媒体报道齐齐哈尔第二制药有限公司生产的假药事件,“齐二药”违反规定,购入工业用“二甘醇”代替医用丙二醇(C3H8O2)作辅料,用于“亮菌甲素注射液”的生产,导致多名患者肾功能衰歇,造成多名患者死亡.二甘醇又称乙二醇醚,分子式为C4H10O3(HO﹣CH2﹣CH2﹣O﹣CH2﹣CH2﹣OH),二甘醇是一种重要的化工原料,可以制取酸、酯、胺等,其主要产品有吗啉及其衍生物1,4﹣二恶烷等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛.二甘醇一般的合成路线为:

请回答下列问题:
(1)下列关于“丙二醇”和“二甘醇”及“乙二醇”的有关说法正确的是
A.丙二醇是乙二醇的同系物
B.它们具有相同种类和数目的官能团,性质上完全相同
C.“丙二醇”和“二甘醇”在病人体内都能被氧化为草酸
D.分离“丙二醇”和“二甘醇”可采用分液的方法
(2)过程Ⅰ是石油加工中常用步骤,其名称为 .
(3)从物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,则为了能得到二甘醇D,物质B到物质C的反应条件是 ,该反应属于 取代反应 (添反应类型).写出B可能生成E的化学方程式: .
(4)物质D是二甘醇,则合成路线中的物质A、B、C的结构简式分别是:
A: B: C:
(5)反应Ⅲ的化学方程式为: .
(6)写出二甘醇制备1,4﹣二恶烷的化学方程式: H.
查看答案和解析>>
科目:高中化学 来源: 题型:
现有含CaO杂质的CaC2试样.设计以下实验,测定CaC2试样的纯度.(反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑),请从下图中选用适当的装置,完成该实验.
(1)制取C2H2最好选④中的丙,所选用装置的连接顺序是(填各接口A~E的顺序): .
(2)若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为 .(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对化学平衡常数K的描述中,正确的是( )
A.K越大,正反应进行的程度越大
B.温度升高,K值增大
C.反应物的转化率增大时,K值一定增大
D.平衡向逆反应方向移动时,K值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L的密闭容器内,800℃时反应2NO(g)+O2(g)
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1) 写出该反应的平衡常数表达式:K=_____________________________________。
已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2的变化的曲线是__________。用O2表示从0~2s内该反应的平均速率v=_____________________________________
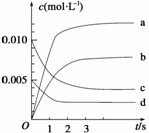
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体b.适当升高温度c.增大O2的浓度d.选择高效催化剂
附加题:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列无色离子一定能大量共存的是( )
|
| A. | 0.1mol•L﹣1MgCl2溶液:K+、H+、S2﹣、Cl﹣ |
|
| B. | 0.1mol•L﹣1的Na2CO3溶液:K+、Ba2+、NO3﹣、Cl﹣ |
|
| C. | 0.1mol•L﹣1的NaOH溶液:K+、Na+、SO42﹣、CO32﹣ |
|
| D. | 1.0mol•L﹣1的KNO3溶液:H+、Fe2+、Cl﹣、SO42﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列三个反应的化学方程式:I2+SO2+2H2O═H2SO4+2HI;2FeCl2+Cl2═2FeCl3,2FeCl3+2HI═2FeCl2+2HCl+I2有关物质的还原性依次增强的顺序是( )
‚
|
| A. | I﹣>Fe2+>Cl﹣>SO2 | B. | Cl﹣>Fe2+>SO2>I﹣ |
|
| C. | Fe2+>I﹣>Cl﹣>SO2 | D. | SO2>I﹣>Fe2+>Cl﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知31 g白磷变成红磷放出18.39 kJ热量,下列两反应中:
P4(s)+5O2(g)===2P2O5(s) ΔH=Q1 kJ·mol-1
4P(红,s)+5O2(g)===2P2O5(s) ΔH=Q2kJ·mol-1
则下列说法中正确的是( )
A.Q1>Q2,白磷比红磷稳定 B.Q1>Q2,红磷比白磷稳定
C.Q1<Q2,白磷比红磷稳定 D.Q1<Q2,红磷比白磷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
从分类的角度来看,下列说法正确的是( )
A. 硅酸、氯化铁均为胶体
B. 水玻璃、氯水均为混合物
C. 食醋、纯碱、食盐分别属于酸、碱盐
D. 氨气属于非电解质,Cu属于电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com