
【题目】已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
温度 物质的量分数 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列说法正确的是
A. 体系中NH3的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时,N2和H2的转化率之比均为1
C. 反应达到平衡时,放出的热量均为92.4kJ
D. 600℃,30MPa下反应达到平衡时,生成NH3的物质的量最多
【答案】B
【解析】A.体系中NH3的物质的量分数越大,不能表示正反应速率越大,如20MPa,500℃时NH3的物质的量分数大于30MPa,600℃时NH3的物质的量分数,但温度和压强均为后者大,反应速率后者快,故A错误;B.根据方程式,反应的氮气和氢气的物质的量之比为1:3,起始反应物中N2和H2的物质的量之比为1:3,因此反应达到平衡时,N2和H2的转化率之比1:1,故B正确;C.无法确定反应的氮气和氢气的物质的量,因此无法计算平衡时,放出的热量,故C错误;D.根据表格数据,反应物的总物质的量不变时,NH3的物质的量分数越大,生成NH3的物质的量越多,则400℃,30MPa下反应达到平衡时,生成NH3的物质的量最多,故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用;②砹(At)是第ⅦA族,其氢化物的稳定性大于HCl;③Na2FeO4可做水的消毒剂和净化剂;④陶瓷、玻璃、水晶、玛瑙、水泥、光导纤维的主要成分都是硅酸盐;⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应;⑥第三周期金属元素的最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱;⑦海水提镁的主要步骤为:

A. ①③④⑦ B. ①③⑥ C. ③④⑤⑦ D. ②④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O (l) =H2O(g); △H=+dkJmol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJmol-1。
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:

t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________ (填“>”“<”或“ = ”)0。
②下列说法正确的是____________ (填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③ 03 min内用CH3OH表示的反应速率v(CH3OH)=________mol L-1·min-1。
④ 200℃时,该反应的平衡常数K =_______。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____________(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CO32-、Cl-、OH-、SO42- |
已知:
①常温下A、C溶液pH均大于7,B溶液pH小于7,D溶液pH等于7;
②C溶液和D溶液混合只产生白色沉淀;
③B溶液和C溶液混合共热时只产生刺激性气味的气体;
④A溶液和D溶液混合时无明显现象。
请回答:
(1)D的化学式_______________________。
(2)实验③反应的离子方程式_______________________。
(3)从B、C、D中选取物质,设计实验方案确定A的组成_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200 mL 2 mol·L-1 HNO3溶液中,逐渐加入铁粉至过量(假设生成的气体只有一种),在此过程中,n(Fe2+)随n(Fe)变化如右图所示。下列有关说法正确的是

A. 当0<n(Fe)≤b时,向所得的溶液中加入KSCN溶液没有血红色出现
B. 向c点处的反应液中加入稀盐酸后无明显现象
C. 当加入铁粉n mol时(0.1<n<0.15),溶液中n(Fe3+)=(0.3-2n)mol
D. 图中a=0.15 、b =0.15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去硫酸铝中含有的Mg2+、K+杂质离子并尽可能减少硫酸铝的损失。
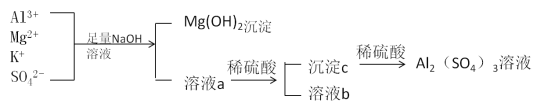
请回答下列问题:
(1)混合物中加入足量氢氧化钠溶液时,反应的离子方程式是________________、________________________________。
(2)能否用氨水代替氢氧化钠溶液____________,其原因是____________________________。
(3)溶液a中存在的离子有________________________,在溶液a中加入稀硫酸时需控制硫酸的量,其原因是__________________________________________,改进方法是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产Na2S2O3·5H2O,实验室用如下装置(略去部分夹持仪器)模拟生成过程。
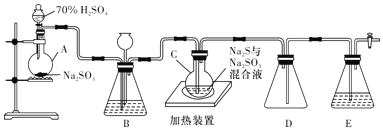
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若____________,则整个装置气密性良好,装理D的作用是___________。装置E中为_________________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则理论上烧瓶C中Na2S和Na2SO3的物质的量之比为____________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择__________(填字母代号)。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是___________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是____________________________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器有_____________。
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O35H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:__________________________________。(已知Na2S2O35H2O遇酸易分解:S2O32- + 2H+ =S↓+ SO2↑+ H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 甲烷分子的比例模型为![]() ,其二氯取代物有2种结构
,其二氯取代物有2种结构
B. 苯和乙烯都能使溴水褪色,其褪色原理相同
C. 相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同
D. 在一定条件下,苯与氯气生成氯苯的反应类型是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下图1,电池的工作原理如下图2。下列有关说法正确的是

A. 放电时,纸张中的纤维素作锂电池的正极
B. 开关K闭合给锂电池充电,X为直流电源负极
C. 放电时,Li+由正极经过有机电解质溶液移向负极
D. 充电时,阳极的电极反应式为:Li2O2+2e-=O2↑+2Li+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com