
| A. | 44g乙醛中所含的氧原子数为NA | |
| B. | 足量的铜与40mL 10mol/L硝酸反应,生成气体的分子数为0.2NA | |
| C. | 14g乙烯中所含的C-H 键数目为2NA | |
| D. | 0.1 mol NH3中所含的电子数为NA |
分析 A.依据n=$\frac{m}{M}$=$\frac{N{\;}_{A}}{N}$,结合1个乙醛含有1个O解答;
B.铜与浓硝酸反应生成二氧化氮,与稀硝酸反应生成一氧化氮;
C.依据n=$\frac{m}{M}$=$\frac{N{\;}_{A}}{N}$,结合1个乙烯分子含有4个C-H键解答;
D.1个氨气分子含有10个电子.
解答 解:A.44g乙醛中所含的氧原子数为:$\frac{44g}{44g/mol}$×NA=NA,故A正确;
B.若足量的铜与40mL 10mol/L硝酸反应完全反应生成二氧化氮物质的量为0.2mol,但是随着反应进行,硝酸浓度降低变为稀硝酸,稀硝酸与铜反应生成一氧化氮,所以产生气体的总量小于0.2mol,故B错误;
C.14g乙烯中所含的C-H 键数目为$\frac{14g}{28g/mol}$×4×NA=2NA,故C正确;
D.0.1 mol NH3中所含的电子数为0.1mol×10×NA=NA,故D正确;
故选:B.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,明确以物质的量为核心的计算公式是解题关键,注意物质的结构组成,题目难度不大.


科目:高中化学 来源: 题型:解答题
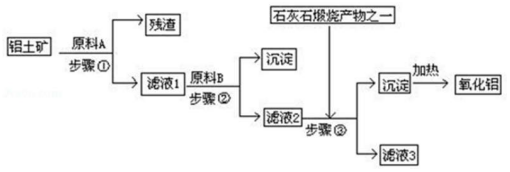
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜,当外电路通过NA个电子时;阳极质量减少32 g | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92kJ•mol-1,当放出热量 9.2 kJ时,转移电子0.6 NA | |
| C. | lmol•L1的氯化铜溶液中,若Cl-的数目为2Na,则Cu2+的数目为NA | |
| D. | 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化产物是SO42- | |
| B. | 氧化剂与还原剂的物质的量之比是1:3 | |
| C. | Cr2O72-表现了氧化性 | |
| D. | 还原1molCr2O72-,电子转移3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀硝酸中加入过量的铁粉充分反应后,滴入KSCN溶液 | 溶液变为血红色 | HNO3具有氧化性,能将Fe氧化成Fe3+ |
| B | 向盛有某溶液的试管中滴加NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸颜色无明显变化 | 原溶液中无NH4+ |
| C | 向淀粉溶液中加入稀硫酸,加热,冷却后加入新制Cu(OH)2,再加热 | 未见红色沉淀 | 淀粉未发生水解 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H2SO4 | |
| B. | Na、Mg与水反应,Na更剧烈 | |
| C. | 气态氢化物的稳定性:HF>HCl | |
| D. | 向Na2SO3溶液中加盐酸,有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,3.36LC2H4和C3H6的混合气体中含有碳碳双键的数目为0.15NA | |
| B. | 0.1mol•L-1(NH4)2SO4溶液与0.2mol•L-1NH4Cl溶液中的NH4+数目相同 | |
| C. | H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 含0.1molNH4HSO4的溶液中,阳离子数目略大于0.21NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | Na+ | Al3+ | Fe3+ | Cu2+ | Ba2+ |
| 阴离子 | OH- | Cl- | CO32- | NO3- | SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
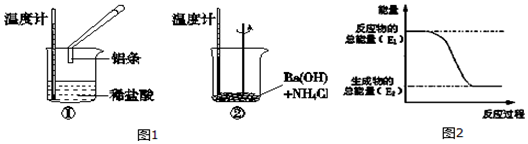

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com