
【题目】现有A、B两种烃,已知A的分子式为C5Hm,而B的最简式为C5Hn(m、n均为正整数)。
(1)下列关于烃A和烃B的说法中不正确的是__________(填字母编号)
a.烃A和烃B可能互为同系物 b.烃A和烃B可能互为同分异构体
c.当m=12时,烃A一定为烷烃 d.当n=11时,烃B可能的分子式有两种
e.烃A和烃B可能都为芳香烃
(2)若烃A为链状烃,且分子中所有碳原子都在一条直线上,则A的结构简式为______。
(3)若烃A为链状烃,分子中所有碳原子不可能都在同一平面上。在一定条件下,1mol A最多只能与1mol H2发生加成反应。写出烃A的名称_________。
(4)若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量浓硫酸,浓硫酸增重1.26g,再通过足量碱石灰,碱石灰增重4.4g,则烃B的分子式为________。若其苯环上的一溴代物只有一种,则符合条件的烃B有________种。
(5)当m= n=4时,取A和B组成的混合物a克完全燃烧后,将产物通过足量Na2O2固体充分吸收,固体增重___________克(用含a的代数式表示)。
【答案】de CH≡C—C≡C-CH3 3-甲基-1-丁烯 C10H14 4 9a/4
【解析】
(1)a.烃A和烃B可能互为同系物,如A为C5H10、B为C10H20的烯烃,故a正确;
b.当n=m时,若B的分子式与A相同而结构不同,则A、B互为同分异构体,故b正确;
c.当烃分子中H原子与C原子数目之比大于2:1时,烃为烷烃,当m=12时,A为戊烷,故c正确;
d.当n=11时,B的分子式为C10H22,则B的结构肯定超过2种,故d错误;
e.烃A的碳原子数小于6,不可能为芳香烃,故e错误。
故答案为:de。
(2)由CH≡CH的4个原子共线可知,要使烃A的5个碳原子共线,满足条件的A的分子中必须有2个-C≡C-,故A为CH≡C-C≡C-CH3,故答案为:CH≡C-C≡C-CH3。
(3)链烃A与H2最多以物质的量之比1:1加成,则A为烯烃C5H10,分子中所有碳原子不可能共平面,则分子中至少有一个饱和碳原子与3个或4个碳原子形成单键,故A只能为3-甲基-1-丁烯,故答案为:3-甲基-1-丁烯。
(4)n(CO2)=4.4g÷44g/mol=0.1mol,n(H2O)=1.26g÷18g/mol=0.07mol,故烃B的最简式为C5H7,B为苯的同系物,设B的分子式为CaH2a-6,故a:(2a-6)=5:7,解得a=10,故B分子式为C10H14,其苯环上的一溴代物只有一种,则符合条件的烃有:
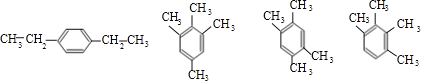 ,
,
故答案为:C10H14;4。
(5)当m=n=4时,A和B的最简式都是C5H4,故混合物平均组成的最简式为C5H4,混合物ag完全燃烧后,通过过氧化钠,过氧化钠增重=混合物含有的氢元素的质量+与混合物中C原子等物质的量的CO的质量,ag混合物最简式的物质的量为ag÷64g/mol=a/64mol,含有氢元素质量为a/64mol×4×1g/mol=a/16g,混合物中碳原子的物质的量为a/64mol×5,与混合物中C原子等物质的量的CO的质量为a/64mol×5×28g/mol=35a/16g,故过氧化钠增重为35a/16g+a/16g=9a/4g,
故答案为:9a/4。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】浓硫酸分别和三种钠盐反应,下列分析正确的是

A. 对比①和②可以说明还原性Br->Cl-
B. ①和③相比可说明氧化性Br2>SO2
C. ②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl
D. ③中浓H2SO4被还原成SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由一氧化碳、甲烷和乙烷组成的混合气体8.96L(标准状况),在足量氧气中充分燃烧后,生成气体先通过足量浓硫酸.再通过足量氢氧化钠溶液,测知氢氧化钠溶液增重26.4g,则原混合气体中乙烷的物质的量为
A. 0.1molB. 大于或等于0.2mo1,小于0.3molC. 等于0.2 molD. 大于0.1mol小于0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列关于0.2 mol·L1 K2SO4溶液的说法正确的是
A. 1 L溶液中K+浓度是0.4 mol·L1
B. 500 mL溶液中含有0.1NA个K+
C. 1 L溶液中所含K+、![]() 总数为0.3NA
总数为0.3NA
D. 2 L溶液中![]() 浓度是0.4 mol·L1
浓度是0.4 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数。下列说法中正确的是( )
A. 1molCl2与1molCH4恰好完全反应,则转移的电子总数为2NA
B. 15g甲基(—CH3)所含电子数为10NA
C. 2.8g ![]() 中含有的碳原子数为0.2n NA
中含有的碳原子数为0.2n NA
D. 标准状况下,2.24LCHCl3含有的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是
A. 14g由N2和13C2H2组成的混合物中,所含中子数为7NA
B. CH4与白磷(P4)都为正四面体结构,则1mol CH4与lmolP4所含共价键的数目均为4NA
C. 反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ/mol,若放出热量4.62kJ,则转移电子的数目为0.3NA
2NH3(g) ΔH=-92.4kJ/mol,若放出热量4.62kJ,则转移电子的数目为0.3NA
D. 常温下,含0.5molNH4NO3与xmolNH3·H2O的中性溶液中,含有NH4+的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A. 小苏打溶液与少量澄清石灰水混合:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. AlCl3溶液中加入足量的氨水:Al3++4OH-===AlO2-+2H2O
C. 将氯气通入水中:Cl2+H2O===Cl-+ClO-+2H+
D. 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)![]() 2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )
2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )
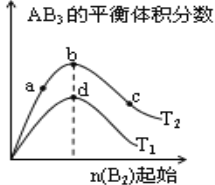
A. 若T2>T1,则正反应一定是放热反应
B. 达到平衡时A2的转化率大小为:b>a>c
C. 若T2>T1,达到平衡时b、d点的反应速率为vd> vb
D. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小为:c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知 W 的一种核素的质量数为 18,中子数为 10;X 和 Ne 的核外电子数相差 1; 在Z所在的周期中,Z 元素的原子得电子能力最强;四种元素的最外层电子数之和为18。 请回答下列问题:
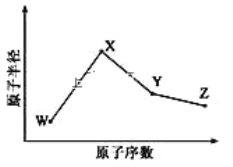
(1)X 元素位于元素周期表中位置为_____________。
(2)X 的单质和 Y 的单质相比,熔点较高的是____________(写化学式) 。 Z 所在族的简单氢化物中,沸点最高的是________(写化学式),原因为_________________________。
(3)W、X、Z 三种元素形成的化合物中化学键类型为________;X2W2的电子式为___________________。
(4)Y 与 Z 形 成的化合物在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为__________________________。
(5)Z 的氧化物很多,其中一种黄绿色气体 M,其氧含量为 47.41%,可用于水处理, M 在液态和浓缩气态时具有爆炸性 。 M 的化学式为_____________。 M 可与 NaOH 溶液反应生成两种稳定的盐,它们的物质的量之比为 1︰5,该反应的化学方程式为___________________。
(6)在 25°C、101kPa 下,已知 Y 的简单气态氢化物在氧气中完全燃烧后恢复至原状态, 平均每转移 1mol 电子放热 190kJ, 该反应的热化学方程式为__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com