
| A. | 氯气与氢气化合比溴与氢气化合容易 | |
| B. | 硒化氢比硫化氢稳定 | |
| C. | 氢氧化锶比氢氧化钙的碱性强 | |
| D. | 铍的原子失电子能力比镁弱 |
分析 A.氯气的氧化性大于溴单质,氧化性越强,与氢气反应的越容易;
B.非金属性越强,对应氢化物的稳定性越强;
C.金属性越强,最高价氢氧化物的碱性越强;
D.铍的金属性小于Mg,则失去电子的能力:Be<Mg.
解答 解:A.由于氯气的氧化性大于溴单质,则氯气与氢气化合比溴与氢气化合容易,故A正确;
B.非金属性:Se<S,则硒化氢不如硫化氢稳定,故B错误;
C.金属性:Sr>Ca,则氢氧化锶比氢氧化钙的碱性强,故C正确;
D.由于金属性:Be<Mg,则失电子能力:Be<Mg,故D正确;
故选B.
点评 本题考查了原子结构与元素周期律的应用,题目难度中等,明确元素周期律的内容为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系,试题培养了是的灵活应用能力.


科目:高中化学 来源: 题型:选择题

| A. | 图中反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 | |
| B. | 图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 | |
| C. | 整个循环过程中产生1mol O2的同时产生44.8LH2 | |
| D. | 设计该循环是为了制取能源气体H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
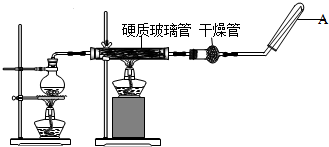
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电电池可以通过放电、充电实现化学能和电能的相互转化 | |
| B. | 放电时负极发生氧化反应,充电时该电极上有物质发生得电子的反应 | |
| C. | 现代技术使得电池设计比较先进,电池废弃后不必再进行无毒化处理 | |
| D. | 充电电池的化学反应原理是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
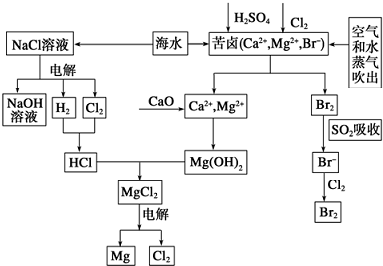
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com