
| A. | 标准状况下,5L CH4气体与5L NH3气体的原子个数之比为5:4 | |
| B. | 常温常压下,11.2L O3中所含氧原子个数大于1.5NA | |
| C. | 同温、同压下,相同体积的N2和CO气体具有相同的分子数和相同的密度 | |
| D. | 同温、同压下,等质量的一氧化碳和二氧化碳的密度比为11:7 |
分析 A.由V=nVm可知相同的状况下,体积之比等于物质的量之比;
B.常温常压下,11.2L O3不是0.5mol;
C.因为N2和CO在同温同压下,体积也相同,所以物质的量相同,分子数相同,因为摩尔质量相同,所以密度相同;
D.同温同压下,密度之比等于摩尔质量的之比.
解答 解:A.相同的状况下,体积之比等于物质的量之比,则CH4气体与NH3气体的物质的量之比为1:1,原子个数之比为5:4,故A正确;
B.常温常压下,11.2L O3不是0.5mol,气体摩尔体积大于22.4L•mol-1,物质的量小于0.5mol,所以原子数小于1.5 NA,故B错误;
C.因为N2和CO在同温同压下,体积也相同,所以物质的量相同,分子数相同,因为摩尔质量相同,所以密度相同,故C正确;
D.同温、同压下,等质量的一氧化碳和二氧化碳的密度比等于气体的摩尔质量之比,为28g/mol:44g/mol=7:11,故D错误.
故选BD.
点评 本题考查物质的量为中心的计算及阿伏伽德罗定律的应用,注意根据阿伏加德罗定律我们可以推断出以下结论:①同温、同压:$\frac{V1}{V2}$=$\frac{n1}{n2}$;②同温、同压:$\frac{ρ1}{ρ2}$=$\frac{M1}{M2}$;③同温、同体积:$\frac{p1}{p2}$=$\frac{n1}{n2}$.本题属于较简单题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

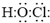 .二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠(NaClO3)和另一种氯的含氯酸盐,同时生成水,该反应的离子方程式为2ClO2+2OH-═ClO3-+ClO2-+H2O
.二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠(NaClO3)和另一种氯的含氯酸盐,同时生成水,该反应的离子方程式为2ClO2+2OH-═ClO3-+ClO2-+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
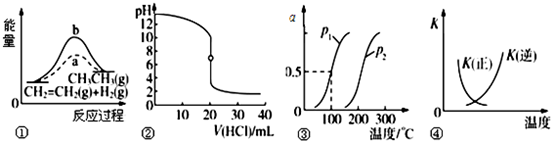
| A. | 图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0;使用和未使用催化剂时,反应过程中的能量变化 | |
| B. | 图②表示25℃时,用0.01mol•L-1盐酸滴定一定体积的0.01mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| C. | 图③表示CH4(g)+H2O(g)?CO(g)+3H2(g)△H,反应CH4的转化率与温度、压强的关系,且P1>P2、△H>0 | |
| D. | 图④中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0;正、逆反应的平衡常数K随温度的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不同元素的原子发生跃迁时,会释放不同的光 | |
| B. | 第一电离能与电负性的数值都是以气态中性基态原子为研究对象测得到 | |
| C. | 分子中的原子有固定的空间位置,组成完全相同的分子,由于原子位置的不同会表现出不同的性质 | |
| D. | 两个相同的原子的任意未成对电子的电子云在两个原子核间重叠,形成非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | b点对应的溶液中:Al3+、Fe3+、SCN-、Cl- | |
| C. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:SO32-、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
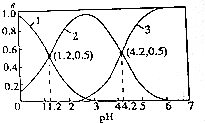 已知:H2SO3?HSO${\;}_{3}^{-}$+H+ Ka1、HSO${\;}_{3}^{-}$?SO${\;}_{3}^{2-}$+H+ Ka2
已知:H2SO3?HSO${\;}_{3}^{-}$+H+ Ka1、HSO${\;}_{3}^{-}$?SO${\;}_{3}^{2-}$+H+ Ka2| A. | 曲线3表示的微粒是SO32- | |
| B. | 溶液pH=4.2时,c(Na+)+c(H+)=c(OH-)+2c(SO32-) | |
| C. | 常温下,$\frac{{K}_{a1}}{{K}_{a2}}$=1000 | |
| D. | 溶液pH=1.2时:c(Na+)+c(H+)=c(OH-)+c(HSO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-2-丁烯 | B. | 3-甲基-1-丁烯 | C. | 3-甲基-2-丁烯 | D. | 2-甲基-1-丁烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com