
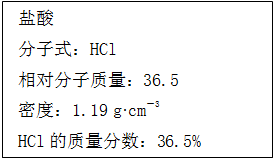
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:| 1000ρω |
| M |
| n |
| V |
| 1000ρω |
| M |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 用亚硫酸溶液无法制取硫酸溶液 |
| B | 升高温度,反应速率越快 | 常温下钠与氧气反应生成氧化钠,升高温度,Na2O的生成速率加快 |
| C | 金属越活泼,其阳离子氧化性越弱 | Fe3+的氧化性弱于Cu2+ |
| D | Ksp小的沉淀易向Ksp更小的沉淀转化 | CaSO4悬浊液中滴加Na2CO3溶液可生成CaCO3沉淀 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列说法中正确的是( )
下列说法中正确的是( )| A、在一定条件下,1 mol该物质最多能和2 mol NaOH反应 |
| B、该物质属于芳香烃 |
| C、该物质不能够和FeCl3反应 |
| D、该物质的分子式为C8H10O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当盐酸加入10mL时,溶液中c(Na+)=2 c(HA-)+2c(A2-)+2 c(H2A) |
| B、当盐酸加入20mL时,溶液中c(Na+)>c(Cl-)>c(HA-)>c(H+)>c(OH-) |
| C、当盐酸加入20mL时,溶液中HA-的数目小于0.002NA |
| D、当盐酸加入40mL时,溶液中c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、200 mL,0.5mol?L-1的NaCl溶液 |
| B、100 mL,0.5mol?L-1的MgCl2溶液 |
| C、150 mL,1mol?L-1的NaCl溶液 |
| D、50 mL,0.5mol?L-1的AlCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com