
 ij�о�С�����÷�ӦCO��g��+H2O��g��?CO2��g��+2H2��g����H=-41.2kJ/mol���Ʊ�CO2��H2�Ļ�����壬����һ���о�CO2��H2�Բ�ͬ�����֮�Ȼ��ʱ�ں��������µķ�Ӧ�������ش��������⣺
ij�о�С�����÷�ӦCO��g��+H2O��g��?CO2��g��+2H2��g����H=-41.2kJ/mol���Ʊ�CO2��H2�Ļ�����壬����һ���о�CO2��H2�Բ�ͬ�����֮�Ȼ��ʱ�ں��������µķ�Ӧ�������ش��������⣺| 1.2mol |
| 1mol |
| 0.12��0.12 |
| 0.08��0.18 |
| 1��x |
| 1��3 |
| y��y |
| (1-y)��(2-y) |
| 2 |
| 3 |
| ||
| 1mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013�������о�У���˸�����ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ������
��һ�̶��ݻ����ܱ������н��������·�Ӧ��
CO2(g) + H2(g)  CO(g) + H2O(g)����ƽ�ⳣ���˺��¶�t�Ĺ�ϵ���£�
CO(g) + H2O(g)����ƽ�ⳣ���˺��¶�t�Ĺ�ϵ���£�
| t�� | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
 H2(g)+CO2(g) ��H=��41.2kJ/mol���Ʊ�CO2��H2�Ļ�����塣�ü�Һ����һ����CO2�ķ�������������H2��CO2������ȡ�����1L1.5mol/L��NaOH��Һ���������22.4L��������Ϊ��״���������CO2�������պ���Һ�и�����Ũ�ȴӴ�С��˳���� ��
H2(g)+CO2(g) ��H=��41.2kJ/mol���Ʊ�CO2��H2�Ļ�����塣�ü�Һ����һ����CO2�ķ�������������H2��CO2������ȡ�����1L1.5mol/L��NaOH��Һ���������22.4L��������Ϊ��״���������CO2�������պ���Һ�и�����Ũ�ȴӴ�С��˳���� �� CO2(g)+ 2H2O��1�� ��H1����890.3 kJ/mol
CO2(g)+ 2H2O��1�� ��H1����890.3 kJ/mol  H2O��1�� ��H2����285.8 kJ/mol
H2O��1�� ��H2����285.8 kJ/mol 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�콭��ʡ�����и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
����������������ЧӦ����Դ��ȱ�����⣬����CO2��̼����Ӧ�õ��о��ܵ����ǵ����ӡ�ij�о�С�����÷�Ӧ��CO(g)+H2O(g) H2(g)+CO2(g)
��H����41.2kJ/mol ���Ʊ�CO2��H2 �Ļ�����壬����һ���о�CO2��H2�Բ�ͬ������Ȼ��ʱ�ں��������µķ�Ӧ����Ӧ�á�
H2(g)+CO2(g)
��H����41.2kJ/mol ���Ʊ�CO2��H2 �Ļ�����壬����һ���о�CO2��H2�Բ�ͬ������Ȼ��ʱ�ں��������µķ�Ӧ����Ӧ�á�
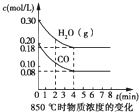
(1) ��֪��850��ʱ��һ���Ϊ10 L�ĺ����ܱ������У�ͨ��һ������CO��H2O��CO��H2OŨ�ȱ仯��ͼ1��ʾ��

����˵����ȷ���� ������ţ�
A.�ﵽƽ��ʱ�����������ʵ�����0.12mol
B.�ﵽƽ��ʱ����Ӧ��ϵ���ջ�ų�49.44kJ����
C.��0��4min����������ƽ����Է�����������
D.��6minʱ���������¶ȣ���Ӧƽ�ⳣ�����С
E.��8minʱ�������뺤�����ᵼ��v��(CO)��v��(H2O)
(2) 850 ��ʱ�������ݻ�Ϊ2 L���ܱ�������ͬʱ����1.0 mol CO��3.0 mol H2O��1.0 mol CO2��x mol H2����Ҫʹ������Ӧ��ʼʱ������Ӧ������У���xӦ����������� ��
(3) �罫H2 ��CO2��4:1������Ȼ�ϣ����ʵ��������¿��Ƶ�CH4����֪��
CH4 (g)+2O2(g)=CO2(g)+ 2H2O(l) ��H1����890.3 kJ/mol
H2(g)+1/2O2(g)=H2O(l) ��H2����285.8 kJ/mol
��CO2(g)��H2(g)��Ӧ����CH4(g)��Һ̬ˮ���Ȼ�ѧ����ʽ�� ��
(4) ������ȼ�ϵ��(��ͼ2����������̼����Ϊ����ʣ���CH4Ϊȼ�ϣ�����Ϊ��������ϡ����������Ϊ�缫����֪�����ĵ缫��Ӧ��CH4 +4CO32����8e��=5CO2+2H2O�������ĵ缫��Ӧ��________��Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ���Ϊ�˵�ع���ʱ�����в���A���ʲμ�ѭ������A���ʵĻ�ѧʽ��_________��ʵ������У���ͨ���˱�״���¿���448 L�����������O2�������Ϊ20%������������ȼ�ϵ�����ı�״����CH4____________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�������о�У���˸�����ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��һ�̶��ݻ����ܱ������н��������·�Ӧ��
CO2(g) + H2(g)  CO(g) + H2O(g)����ƽ�ⳣ���˺��¶�t�Ĺ�ϵ���£�
CO(g) + H2O(g)����ƽ�ⳣ���˺��¶�t�Ĺ�ϵ���£�
|
t�� |
700 |
800 |
850 |
1000 |
1200 |
|
K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1) K�ı���ʽΪ���� �� �������÷�Ӧ������ӦΪ���� ����Ӧ�������ȡ����ȡ���
(2) ���жϸ÷�Ӧ�Ƿ��Ѿ��ﵽ��ѧƽ��״̬���ǣ�
����������ѹǿ���䡡�� �£����������COŨ�Ȳ���
�ã�v(H2)��= v(H2O)�桡�� D��c(CO2) = c(CO)��
��3��ij�о�С�����÷�Ӧ��CO(g)+H2O(g)  H2(g)+CO2(g) ��H=��41.2kJ/mol���Ʊ�CO2��H2�Ļ�����塣�ü�Һ����һ����CO2�ķ�������������H2��CO2������ȡ�����1L1.5mol/L��NaOH��Һ���������22.4L��������Ϊ��״���������CO2�������պ���Һ�и�����Ũ�ȴӴ�С��˳���� ��
H2(g)+CO2(g) ��H=��41.2kJ/mol���Ʊ�CO2��H2�Ļ�����塣�ü�Һ����һ����CO2�ķ�������������H2��CO2������ȡ�����1L1.5mol/L��NaOH��Һ���������22.4L��������Ϊ��״���������CO2�������պ���Һ�и�����Ũ�ȴӴ�С��˳���� ��
��4���罫H2��CO2��4:1������Ȼ�ϣ����ʵ��������¿��Ƶ�CH4����֪��
CH4 (g) + 2O2(g)  CO2(g)+ 2H2O��1�� ��H1����890.3 kJ/mol
CO2(g)+ 2H2O��1�� ��H1����890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O��1�� ��H2����285.8 kJ/mol
H2O��1�� ��H2����285.8 kJ/mol
��CO2(g)��H2(g)��Ӧ����CH4(g)��Һ̬ˮ���Ȼ�ѧ����ʽ�� ��
��5��������ȼ�ϵ������ͼ��

��ͼ��������̼����Ϊ����ʣ���CH4Ϊȼ�ϣ�����Ϊ��������ϡ����������Ϊ�缫����֪�����ĵ缫��Ӧ��CH4 +4CO32����8e��=5CO2+2H2O�������ĵ缫��Ӧ��_______ ��Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ���Ϊ�˵�ع���ʱ�����в���A���ʲμ�ѭ������A���ʵĻ�ѧʽ��_________��ʵ������У���ͨ���˱�״���¿���448L�����������O2�������Ϊ20%������������ȼ�ϵ�����ı�״����CH4____________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡģ���� ���ͣ������
 H2(g)+CO2(g) ��H=��41.2kJ/mol ���Ʊ�CO2��H2 �Ļ�����壬����һ���о�CO2��H2�Բ�ͬ������Ȼ��ʱ�ں��������µķ�Ӧ����Ӧ�á�
H2(g)+CO2(g) ��H=��41.2kJ/mol ���Ʊ�CO2��H2 �Ļ�����壬����һ���о�CO2��H2�Բ�ͬ������Ȼ��ʱ�ں��������µķ�Ӧ����Ӧ�á�
 CO2(g)+ 2H2O(l) ��H1����890.3 kJ/mol
CO2(g)+ 2H2O(l) ��H1����890.3 kJ/mol  H2O(l) ��H2����285.8 kJ/mol
H2O(l) ��H2����285.8 kJ/mol �鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com