
| | X | Y | Z |
| 第一电离能(KJ/mol) | 520.2 | 495.8 | 418.8 |


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.(A-x+n) mol | B.(A-x-n) mol |
C.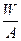 (A-x+n) mol (A-x+n) mol | D.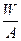 (A-x-n) mol (A-x-n) mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同周期元素的原子半径以ⅦA族的为最大 |
| B.同主族两种元素原子的核外电子数的差值可能为26 |
| C.短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素 |
| D.科学家在周期表中金属与非金属分界线处找到了优良的催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素代号 | A | B | D | E | G | H | I | J |
| 常见化合价 | -1 | -2 | +4、-4 | +6、+4、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/pm | 64 | 66 | 77 | 104 | 110 | 143 | 160 | 186 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1S22S22P63S23P64S 1与1S22S22P63S1 |
| B.1S22S22P63S2与1S22S22P63S23P1 |
| C.1S22S22P63S23P4与1S22S22P6 |
| D.1S22S22P2与1S22S22P5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属性逐渐增强 |
| B.离子的氧化性逐渐减小 |
| C.金属的熔点逐渐升高 |
| D.原子半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第3周期 |
| B.第2周期 |
| C.第ⅣA族 |
| D.第ⅤA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com