
| A. | 无色 | B. | 红色 | C. | 蓝色 | D. | 浅绿色 |
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:填空题
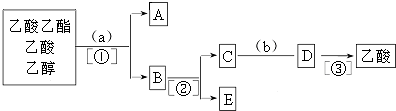
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
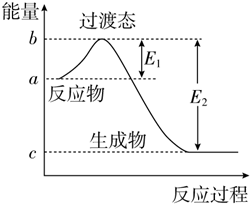 如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )
如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )| A. | 若在反应体系中加入催化剂,E1不变 | |
| B. | 若在反应体系中加入催化剂,△H减小 | |
| C. | 反应的活化能等于y kJ•mol-1 | |
| D. | 1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的△H=(x-y) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
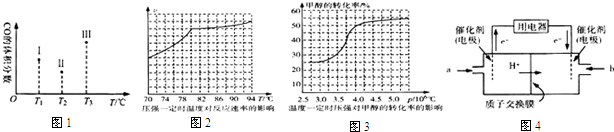
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在FeO•FeyCrxO3中3x=y | |
| B. | 消耗硫酸亚铁铵的物质量为n(2-x)mol | |
| C. | 反应中发生转移的电子数为3nx mol | |
| D. | 处理废水中Cr2O72- 的物质量为$\frac{nx}{2}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
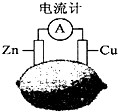
| A. | 该装制能将电能转换为化学能 | B. | 电子由铜片流出经导线到锌片 | ||
| C. | 一段时间后,锌片质量减轻 | D. | 铜片一侧产生Cu2+使柠檬变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
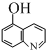 )是白色或淡黄色粉末,可通过如下实验步骤制得:
)是白色或淡黄色粉末,可通过如下实验步骤制得: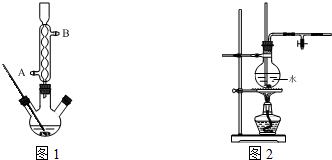
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ab | B. | cd | C. | ef | D. | gh |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com