
【题目】实验小组探究铝片做电极材料时的原电池反应,实验如下:
① | ② | ③ |
|
|
煮沸冷却后的溶液 |
电流计指针向右偏转,镁片、铝片表面产生无色气泡 | 电流计指针迅速向右偏转,逐渐向零刻度恢复,经零刻度后继续向左偏转;镁片表面开始时无明显现象,一段时间后有少量气泡逸出;铝片表面持续有气泡逸出。 | 电流计指针向左偏转。铝片表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝片表面气泡略有减少。 |
下列说法不正确的是
A. 实验①中,镁片做原电池的负极
B. 实验②中,初始时的实验现象对应的原电池反应为:2Mg + O2 + 2H2O ![]() 2Mg( OH) 2
2Mg( OH) 2
C. 实验②中,一段时间后,铝片发生的电极反应式为:Al - 3 e - ![]() Al 3+
Al 3+
D. 实验① ~ ③可推知,铝片做电极材料时的原电池反应与另一个电极的电极材料、溶液的酸碱性、溶液中溶解的O2等因素有关
【答案】C
【解析】
A.实验①中,电解质溶液为盐酸,镁和铝都可以和盐酸反应,但是金属镁更活泼为负极,故A正确;
B.实验②中,初始时镁为负极,失电子发生氧化反应,电极反应式为Mg+2OH--2e-=Mg(OH)2↓,Al为正极,溶解的氧气在此电极得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,
电池总反应2Mg + O2 + 2H2O ![]() 2Mg( OH) 2↓,故B正确;
2Mg( OH) 2↓,故B正确;
C.实验②中,一段时间后,铝为负极失电子发生氧化反应,电极反应式为2Al+8OH--6e-=2AlO2-+4H2O,镁为正极,氢离子在此电极得电子发生还原反应,电极反应式为6H2O+6e-=3H2↑+6OH-,故C错误;
D. 实验① ~ ③可推知,铝片做电极材料时的原电池反应与另一个电极的电极材料、溶液的酸碱性、溶液中溶解的O2等因素有关,故D正确。答案选C。


科目:高中化学 来源: 题型:
【题目】尼美舒利是一种非甾体抗炎药,它的一种合成路线如下:

已知:
回答下列问题:
(1)A的化学名称为___________。
(2)B的结构简式为___________。
(3)由C生成D的化学方程式为___________,E→F的反应类型为___________。
(4)C中的官能团有___________、___________(填官能团名称)。
(5)由甲苯为原料可经三步合成2,4,6-三氨基苯甲酸,合成路线如下:

反应①的试剂和条件为___________;中间体B的结构简式为___________;反应③试剂和条件为___________。
(6)E的同分异构体中能同时满足下列条件的共有___________种(不含立体异构);
①含有两个苯环且两个苯环直接相连
②能与FeCl3溶液发生显色反应
③两个取代基不在同一苯环上
其中核磁共振氢谱为6组峰,峰面积比为2︰2︰2︰2︰2︰1的结构简式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,当溶液中离子浓度小于1×10-5mol·L-1时,可认为该离子沉淀完全。下列叙述正确的是( )
A. 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
B. 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小
C. 向0.000 8 mol·L-1的K2CrO4溶液中加入等体积的0.002 mol·L-1AgNO3溶液,则CrO42-完全沉淀
D. 将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液,则先产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)与H2(g)在铁催化剂表面经历如图所示过程生成NH3,下列说法正确的是

A. Ⅰ中破坏的均为极性键
B. Ⅱ、Ⅲ、Ⅳ均为放热过程
C. Ⅳ中NH2与H2生成NH3
D. N2(g)+3H2(g) ![]() 2NH3(g)ΔH>0
2NH3(g)ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )

A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重危害人类健康和生态环境,开发稳定高效的脱硫脱硝工艺技术是国内外研究的热点。研究表明,氮氧化物(NOx)和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如下图所示。
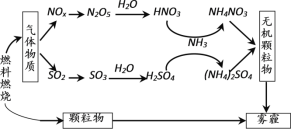
(1)NH3的电子式是_________。
(2)NH4NO3溶液中的离子浓度由大到小顺序是_________。
(3)①已知:SO2生成SO3总反应方程式是
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol
此反应可通过如下两步完成:
2NO(g)+O2 (g ) ![]() 2NO2(g) ΔH1=-113 kJ/mol
2NO2(g) ΔH1=-113 kJ/mol
NO2(g)+SO2(g) ![]() SO3(g)+NO(g) ΔH2=_________。
SO3(g)+NO(g) ΔH2=_________。
② 一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO2和NO的浓度之比为1∶3,则NO2的平衡转化率是_________。
(4)利用NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。
① 制备少量NaClO2,其装置如下图所示:

装置I控制温度在35~55℃,通入SO2将NaClO3还原为ClO2(沸点:11℃),反应的离子方程式是_____________________________________________,
装置Ⅱ中反应生成NaClO2,此反应中作为氧化剂的是_______________,反应后溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH-外还可能含有的一种阴离子是_______________。
② 用制得的NaClO2/H2O2酸性复合吸收剂同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液pH对脱硫脱硝的影响如下图所示:
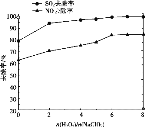
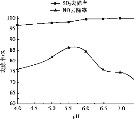
从上图中可知脱硫脱硝最佳条件是_________。图 中SO2的去除率随pH的增大而增大,而NO 的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )
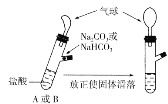
A.B装置的气球膨胀的体积大
B.最终两试管中NaCl的物质的量一定相同
C.若最终两气球体积不同,则盐酸的浓度一定小于或等于1mol/L
D.若最终两气球体积相同,则盐酸的浓度一定大于或等于2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应N2+3H2![]() 2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )
2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A. 加催化剂,v正、v逆都发生变化,且变化的倍数相等
B. 加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
C. 降温,v正、v逆减小,且v正减小的倍数大于v逆减小的倍数
D. 体积不变,加入氩气,v正、v逆都保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应H2(g)+ I2(g)![]() 2HI(g),1 mol H2完全反应放出a kJ的热量,依据下表数据,以下说法错误的是( )
2HI(g),1 mol H2完全反应放出a kJ的热量,依据下表数据,以下说法错误的是( )
化 学 键 | H—H | I—I |
断开1 mol化学键时吸收的能量(kJ) | b | c |
A.该反应中反应物的总能量高于生成物的总能量
B.断开1 mol H-H 键和1 mol I-I 键所需能量大于断开2 mol H-I 键所需能量
C.断开2 mol H-I键所需能量为(a+b+c)kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com