
| A、反应①②③中的氧化产物分别是I2、Fe3+、CoCl2 |
| B、根据以上方程式可以得到氧化性Cl2>Fe3+>Co2O3 |
| C、在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化 |
| D、可以推理得到I2+Fe2+═2I-+Fe3+ |


科目:高中化学 来源: 题型:
| A、还原剂失电子数目越多,其还原性越强 |
| B、有单质参加的化合反应一定是氧化还原反应 |
| C、阳离子只有氧化性,阴离子只有还原性 |
| D、氧化还原反应中,某元素由化合态变为游离态,此元素一定被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的离子积不变 |
| B、水的pH变小,呈酸性 |
| C、水的pH变大,呈中性 |
| D、水中C(H+)=C(OH-)>1×10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H<0,△S>0,所有温度下反应都自发进行 |
| B、△H>0,△S>0,所有温度下反应都自发进行 |
| C、△H<0,△S<0,高温下反应自发进行 |
| D、△H>0,△S<0,所有温度下反应都自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当△H<0时,表示该反应为吸热反应 |
| B、放热反应可以自发进行,而吸热反应需加热才能进行 |
| C、1molCH4完全燃烧生成CO2和水蒸气放出的热量大于生成CO2和液态水放出的热量 |
| D、化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
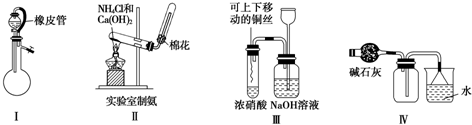
| A、利用Ⅰ装置检查气密性,打开分液漏斗活塞,液体顺利流下 |
| B、利用Ⅱ装置制取NH3 |
| C、利用Ⅲ装置进行铜与浓硝酸反应的实验 |
| D、利用Ⅳ装置收集NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、1:10 |
| C、1:2 | D、1:20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com