
平衡(A)C2H4(g) ![]() C2H2(g)+H2(g),(B)2CH4(g)
C2H2(g)+H2(g),(B)2CH4(g) ![]() C2H4(g)+2H2(g),当升高温度时(A)和(B)平衡皆向右移动。
C2H4(g)+2H2(g),当升高温度时(A)和(B)平衡皆向右移动。
(1)C(s)+2H2(g)====CH4(g) ΔH1;
(2)2C(s)+H2(g)====C2H2(g) ΔH2;
(3)2C(s)+2H2(g)====C2H4(g) ΔH3;
判断(1)、(2)和(3)中ΔH1、ΔH2、ΔH3的大小顺序排列正确的是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH2>ΔH3>ΔH1
C.ΔH2>ΔH1>ΔH3 D.ΔH3>ΔH2>ΔH1
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:阅读理解
| 温度(K) CO2转化率(%) n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
| n(H2) |
| n(CO2) |

查看答案和解析>>
科目:高中化学 来源: 题型:
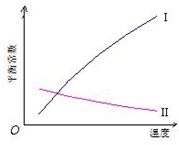 (2009?惠州二模)醇脱水反应在不同温度条件下得到的产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.
(2009?惠州二模)醇脱水反应在不同温度条件下得到的产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.| 温度(℃) | 乙醇转化率(%) | 有机产物含量(体积分数) | |
| 乙烯(%) | 乙醚(%) | ||
| 125 | 20 | 8.7 | 90.2 |
| 150 175 200 |
68 88 90 |
16.7 32.3 86.9 |
82.2 66.8 12.1 |


查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| A、X>y>Z |
| B、X>Z>Y |
| C、Y>X>Z |
| D、Z>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于平衡①C2H2+H2?C2H4和平衡,②2CH4?C2H4+2H2,在其他条件不变时,温度降低,①式向右移动,②式向左移动,
则热化学方程式C(s)+2H2(g)?CH4+Q1,2C(s)+H2(g)?C2H2(g)+2Q2和2C(s)+2H2(g)?C2H4(g)+2Q3中Q1、Q2、Q3的值大小比较是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com