
| A. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-) | |
| B. | 20ml0.1mol/LCH3COONa溶液与10ml0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
分析 A.二者恰好完全反应生成碳酸钠和水,碳酸钠物质的量浓度为0.05mol/L,碳酸根离子水解导致溶液呈碱性,但其水解程度较小;
B.二者混合后溶液中溶质为等物质的量浓度的CH3COONa、NaCl、CH3COOH,混合溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度;
C.室温下,pH=2的盐酸浓度小于pH=12的氨水浓度,二者等体积混合,氨水有剩余,溶液呈碱性,根据电荷守恒判断离子浓度大小;
D.二者恰好完全反应生成醋酸钠和水,醋酸钠水解导致溶液呈碱性,溶液中存在质子守恒,根据质子守恒判断.
解答 解:A.二者恰好完全反应生成碳酸钠和水,碳酸钠物质的量浓度为0.05mol/L,碳酸根离子水解导致溶液呈碱性,但其水解程度较小,钠离子不水解,水还电离生成氢氧根离子,所以离子浓度大小顺序是c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)故A错误;
B.二者混合后溶液中溶质为等物质的量浓度的CH3COONa、NaCl、CH3COOH,混合溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度,氯离子不反应,所以离子浓度大小顺序是c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故B正确;
C.室温下,pH=2的盐酸浓度小于pH=12的氨水浓度,二者等体积混合,氨水有剩余,溶液呈碱性,根据电荷守恒得c(NH4+)>c(Cl-),一水合氨电离程度较小,所以离子浓度大小c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C正确;
D.二者恰好完全反应生成醋酸钠和水,醋酸钠水解导致溶液呈碱性,溶液中存在质子守恒,根据质子守恒得c(OH-)=c(H+)+c(CH3COOH),故D错误;
故选BC.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质成分及其性质是解本题关键,侧重考查学生分析判断能力,注意A中发生反应,易错选项是A.


科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.64 | 0.50 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | T1<T2,Q>0 | |
| B. | 增大压强,B的转化率减小 | |
| C. | 当混合气体的密度不再变化,反应达平衡状态 | |
| D. | a+b<c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
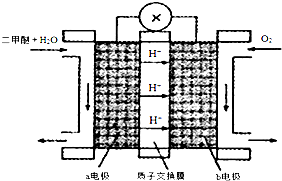
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
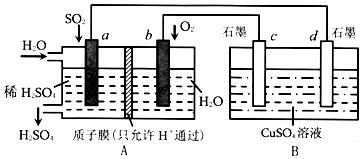
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
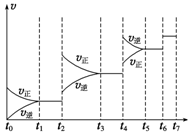
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
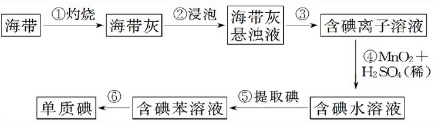
| 密度(g/cm3) | 熔点(.C) | 沸点(.C) | |
| 碘 | 4.93 | 113.5 | 184.35 |
| 苯 | 0.885 | 80.10 | 5.53 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
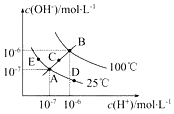 已知水的电离平衡曲线如图示,试回答下列问题:
已知水的电离平衡曲线如图示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸氢钠与盐酸反应:CO3-+2H+═H2O+CO2↑ | |
| C. | 醋酸溶液与氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 金属铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com