
| A. | 酸性:HXO4<H2Y O4<H3ZO4 | B. | 气态氢化物的稳定性:X<Y<Z | ||
| C. | 非金属性:X>Y>Z | D. | 元素负化合价的绝对值:X>Y>Z |
分析 同周期元素X、Y、Z,其最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,可知X、Y、Z的最高正价分别为+7、+6、+5,则非金属性X>Y>Z,然后结合元素周期律来解答.
解答 解:同周期元素X、Y、Z,其最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,可知X、Y、Z的最高正价分别为+7、+6、+5,则非金属性X>Y>Z,
A.非金属性越强,对应最高价含氧酸的酸性越强,则酸性:HXO4>H2YO4>H3ZO4,故A错误;
B.非金属性越强,对应氢化物越稳定,则气态氢化物的稳定性:X>Y>Z,故B错误;
C.由上述分析可知,非金属性:X>Y>Z,故C正确;
D.X、Y、Z的最高正价分别为+7、+6、+5,元素负化合价的绝对值:X<Y<Z,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握同周期元素对应的最高价含氧酸与非金属性的关系为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 锗的第一电离能高于碳而电负性低于碳 | |
| B. | 乙烯分子中,只有一个碳碳π键,四个碳氢σ键 | |
| C. | 在铁制品上镀铜时,镀件为阳极,铜盐溶液为电镀液 | |
| D. | 甲醇分子内的O-C-H键角小于甲醛分子内O-C-H键角 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
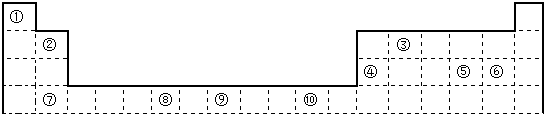
 .
. ;⑥和⑦形成的化合物电子式为
;⑥和⑦形成的化合物电子式为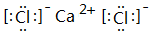 .③和⑥形成的化合物晶体类型为分子晶体.元素①的4个原子与元素③的2个原子形成的分子中含有σ键的数目为5,π键数目为1.
.③和⑥形成的化合物晶体类型为分子晶体.元素①的4个原子与元素③的2个原子形成的分子中含有σ键的数目为5,π键数目为1.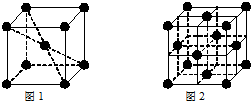
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气能在氧气中燃烧,说明氧气具有可燃性 | |
| B. | 水通电分解时生成氢气和氧气,说明水是由氢气和氧气组成 | |
| C. | 将石蕊试液滴入稀硫酸中溶液显红色,说明石蕊试液能使酸变红 | |
| D. | 通过在显微镜下观察木炭,得知木炭具有疏松多孔的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | |
| B. | 存在Fe2+的溶液中:Mg2+、SO42-、ClO-、Na+ | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 高锰酸钾溶液:H+、Na+、SO42-、葡萄糖分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
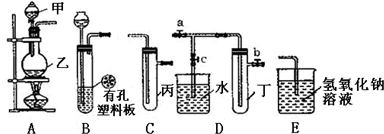
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;用E的氧化物和氯化物都能干燥的气体有d
;用E的氧化物和氯化物都能干燥的气体有d查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ②③④⑤⑥① | C. | ④⑤⑥②①③ | D. | ⑥④①②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ | |
| B. | 铁粉加入三氯化铁溶液中:2Fe+Fe3+=3Fe2+ | |
| C. | AlCl3溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O | |
| D. | FeCl2溶液中加入氯水:Cl2+2 Fe2+=2 Fe3++2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com