
【题目】反应A(g)+ B(g)![]() C(g) +2D(g)的能量变化如图所示,回答下列问题。
C(g) +2D(g)的能量变化如图所示,回答下列问题。

(1)该反应是_______________反应(填“吸热”“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率_______(填“增大”“减小”“不变”下同),原因是__________________;
(3)向体系中加入催化剂,△H_____________;
(4)向体系中加入催化剂,反应速率增大,E1和E2的变化是E1______E2_____ ;
(5)将1molA和2molB加入2L容器中,5min后达到平衡,此时A的转化率为50%,则5min内用D表示化学反应速率为___________平衡常数K=________________
【答案】放热 减小 温度升高向吸热反应方向移动,向逆反应方向进行,A的转化率减小 不变 减小 减小 0.1mol/(L![]() min) 0.33
min) 0.33
【解析】
根据图示中反应物及生成物总能量相对大小判断反应是否放热;根据平衡移动原理分析平衡的移动方向及转化率的变化;根据催化剂对反应的影响分析反应热及活化能的变化;根据平衡常数的表达式,运用三段式法进行相关计算。
(1)由图可知:反应物的总能量高于生成物的总能量,所以应反应是放热反应,故答案为:放热;
(2)正反应是放热反应,所以升高温度平衡逆向移动,A的转化率减小,故答案为:减小;温度升高向吸热反应方向移动,向逆反应方向进行,A的转化率减小;
(3)反应热的大小与外界条件无关,只与反应物和生成物的总能量大小有关,所以向体系中加入催化剂,△H不变,故答案为:不变;
(4)向体系中加入催化剂,降低反应的活化能,所以E1和E2都减小,故答案为:减小;减小;
(5)运用三段式法计算得:
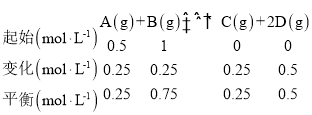
v=![]() =0.1mol/(L
=0.1mol/(L![]() min);K=
min);K=![]() =0.33,故答案为:0.1mol/(L
=0.33,故答案为:0.1mol/(L![]() min);0.33。.
min);0.33。.


科目:高中化学 来源: 题型:
【题目】某新型电池的工作原理为Li1-xAO2+LixCn ![]() LiAO2+nC
LiAO2+nC![]() 可以是Co、Ni、Fe等
可以是Co、Ni、Fe等![]() ,碳作为金属锂的载体。下列说法正确的是
,碳作为金属锂的载体。下列说法正确的是![]()
![]()

A.充电时,a极与充电电源正极相连
B.放电时,负极电极反应式为![]()
C.![]() 中Li为
中Li为![]() 价
价
D.用该电池电解饱和食盐水,当产生1mol氢气时,理论上a极材料质量增加14g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大
B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
C.在高锰酸钾溶液中,H+、K+、SO42-、葡萄糖分子可以大量共存
D.已知:Ksp(AgCl)=1.8×10-10, Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4的溶解度小于AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的化工产品之一,研究合成氨反应具有重要意义。
(1)已知断裂下列化学键需要吸收的能量分别为:![]() ,
,![]() ,
,![]() ,写出以N2和H2为原料合成NH3的热化学方程式______。
,写出以N2和H2为原料合成NH3的热化学方程式______。
(2)某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如下图 所示:
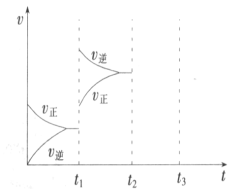
①t1时刻改变的条件为__________________。
②t2时刻,恒压充入氦气,t3时刻达到平衡。在图中画出t2时刻后的速率变化图像_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量A、B混合气体发生反应:aA(g)+bB(g)![]() cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
A. a+b=cB. 该变化使平衡正向移动
C. B的转化率降低D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2的叙述中,正确的是( )
A. SO2的摩尔质量是64g
B. 1 molSO2中所含分子数约为6.02×1023个
C. 1 molSO2的质量是64g/mol
D. 常温常压下,1 molSO2的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
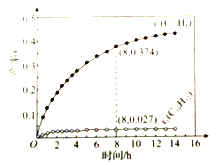
【题目】335℃时,在恒容密闭反应器中1.00mol![]() 催化脱氢的反应过程如下:
催化脱氢的反应过程如下:
反应1:![]()
反应2:![]()
测得![]() 和
和![]() 的产率
的产率![]() 和
和![]() (以物质的量分数计)随时间的变化关系及反应过程中能量的变化如图所示。下列说法错误的是( )
(以物质的量分数计)随时间的变化关系及反应过程中能量的变化如图所示。下列说法错误的是( )
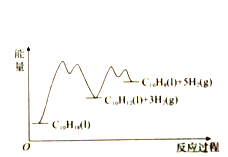
A. 使用催化剂能改变反应历程
B. 更换催化剂后![]() 、
、![]() 也会随之改变
也会随之改变
C. 8h时,反应1、2都未处于平衡状态
D. ![]() 显著低于
显著低于![]() ,是由于反应2的活化能比反应1的小,反应1生成的
,是由于反应2的活化能比反应1的小,反应1生成的![]() 很快转变成
很快转变成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
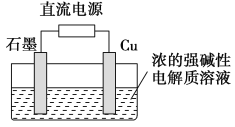
A. 铜电极发生还原反应 B. 石墨电极上产生氢气
C. 铜电极接直流电源的负极 D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下重水中存在电离平衡D2O![]() D++OD-,D2O的离子积常数=1.0×10-12,若pD=-lgc(D+),该温度下有关分析正确的是( )
D++OD-,D2O的离子积常数=1.0×10-12,若pD=-lgc(D+),该温度下有关分析正确的是( )
A.0.1molNaOD溶于重水制成1L溶液,pD=13
B.将pD=4的DCl的重水溶液稀释100倍,所得溶液pD=6
C.pD=10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10-10mol·L-1
D.向30mL0.5mol·L-1NaOD的重水溶液中加入20mL0.5mol·L-1 DCl的重水溶液,所得溶液pD=12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com