
(12分)氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁燃料,其燃烧产物为________。
(2)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为__________________________________________,反应消耗1 mol NaBH4时转移的电子数目为________。
(3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:

在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。

①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。( ,计算结果保留小数点后1位)
,计算结果保留小数点后1位)
(12分)(1)H2O(1分)
(2)NaBH4+2H2O===NaBO2+4H2↑
4NA或2.408×1024
(3)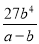 mol3·L-3
mol3·L-3
(4)①A→D(1分) ②C6H6+6H++6e-===C6H12 ③64.3%
【解析】
试题分析:(1)氢气在氧气中燃烧的产物是H2O;
(2)根据题意可知NaBH4中B的化合价不变,始终是+3价,则H元素的化合价是-1价,所以与水反应的产物还有氢气,化学方程式为NaBH4+2H2O===NaBO2+4H2↑;反应消耗1 mol NaBH4时,生成4mol氢气,其中一半是氧化产物,一半是还原产物,所以转移的电子数目是2mol×2×NA=4NA;
(3)平衡时苯的浓度是b mol·L-1,则氢气的浓度是3 b mol·L-1,环己烷的平衡浓度是(a- b )mol·L-1,属于该反应的平衡常数K= b mol·L-1×(3 b mol·L-1)3/(a- b )mol·L-1=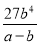 mol3·L-3
mol3·L-3
(4)①根据图示可知,苯生成环己烷是还原反应,所以D是阴极,则A是负极,所以电子的流向是A→D;
②苯得到电子生成环己烷是目标产物,发生还原反应,电极反应式为C6H6+6H++6e-===C6H12
③阳极生成的2.8mol气体应是氧气,转移电子的物质的量是2.8mol×4=11.2mol,设阴极消耗苯的物质的量是xmol,转移6xmol电子,生成xmol环己烷,根据得失电子守恒可知,阴极还产生氢气,物质的量是(11.2-6x)/2mol,10mol的混合气中苯的物质的量是10mol×24%=2.4mol,后来得到含苯10%的混合气,则剩余苯的物质的量是(2.4-x)mol,由于电解池中的高分子电解质膜只允许氢离子通过,所以左侧得到的含苯的物质的量分数是10%的混合气的物质的量是[10+(11.2-6x)/2]mol,所以(2.4-x)/ [10+(11.2-6x)/2]=10%,解得x=1.2,电流效率η=6×1.2/11.2×100%=64.3%。
考点:考查氧化还原反应的计算,平衡常数的表达,电解反应原理的应用


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源:2014-2015安徽省高二上学期第一次质量检测化学试卷(解析版) 题型:填空题
(3分)在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则该反应的热化学方程式应为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市三校高二上学期期中化学试卷(解析版) 题型:选择题
下列物质分类组合正确的是
| A | B | C | D |
强电解质 | HBr | FeCl3 | H3PO4 | Ca(OH)2 |
弱电解质 | HF | CH3COOH | BaSO4 | HI |
非电解质 | NH3 | Cu | H2O | C2H5OH |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市三校高一上学期期中化学试卷(解析版) 题型:选择题
将30 mL 0.5mol/L的NaOH溶液加水稀释到500 mL,稀释后NaOH的物质的量浓度为
A.0.3 mol/L B.0.03 mol/L C.0.05 mol/L D.0.04 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市三校高一上学期期中化学试卷(解析版) 题型:选择题
摩尔是
A.国际单位制的一个基本物理量
B.表示物质质量的单位
C.计量微观粒子的物质的量的单位
D.表示6.02×1023个粒子的集体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高二10月月考化学试卷(解析版) 题型:选择题
在醋酸中存在电离平衡:CH3COOH CH3COO-+H+,要使电离平衡右移且c(H+)增大,应采取的措施是
CH3COO-+H+,要使电离平衡右移且c(H+)增大,应采取的措施是
A.加入NaOH(s) B.加入盐酸
C.加蒸馏水 D.升高温度
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高二10月月考化学试卷(解析版) 题型:选择题
已知:锂离子电池的总反应为LixC+Li1-xCoO2 C+LiCoO2,锂硫电池的总反应2Li+S
C+LiCoO2,锂硫电池的总反应2Li+S Li2S
Li2S
有关上述两种电池说法正确的是
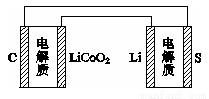
A.锂离子电池放电时, Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.右图表示用锂离子电池给锂硫电池充电
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高二10月月考化学试卷(解析版) 题型:选择题
锌铜原电池(如图)工作时,下列叙述正确的是
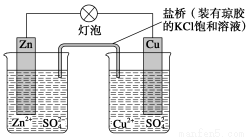
A.正极反应为Zn-2e-===Zn2+
B.电池反应为Zn+Cu2+===Zn2++Cu
C.在外电路中,电流从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江安达市高二第一次月考试卷化学试卷(解析版) 题型:填空题
(8分)钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na(l)+ KCl(l) NaCl(l)+ K(g) ΔH>0 该反应的平衡常数可表示为:K = C(K) 各物质的沸点与压强的关系见下表。
NaCl(l)+ K(g) ΔH>0 该反应的平衡常数可表示为:K = C(K) 各物质的沸点与压强的关系见下表。
压强(kPa) | 13.33 | 53.32 | 101.3 |
K的沸点(℃ ) | 590 | 710 | 770 |
Na的沸点(℃ ) | 700 | 830 | 890 |
KCl的沸点(℃ ) |
|
| 1437 |
NaCl的沸点(℃ ) |
|
| 1465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 ;
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是 (任写一条);(3)常压下,当反应温度升高至 900℃ 时,该反应的平衡常数可表示为:K = 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com