
下列离子反应方程式能正确表达相关反应的是
A.在FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
B.用石墨电极电解氯化镁溶液:2Cl-+2H2O电解Cl2↑+H2↑+2OH-
C.向CaCl2溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+
D.等物质的量浓度的小苏打溶液和石灰水按体积比3:2混合:
3HCO3-+2Ca2++3OH-=2CaCO3↓+CO32-+3H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:实验题
【选修2-化学与技术】(15分)
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:

已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是________(填化学式),若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______________________。
(2)在操作①中保持pH=8的目的是_________________________________。
(3)沉淀Ⅰ的主要成分是___________________________________________。
(4)操作③中加热、煮沸的目的是___________。此步骤操作的理论依据是_______________。
(5)操作④保持pH=2的目的是_______。此步骤操作中所用的主要仪器是_____ ______。
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:填空题
(6分)苹果酸结构如下,常用做汽水、糖果的添加剂。

试写出苹果酸分别与下列物质反应的化学方程式:
(1)与Na 。
(2)与Na2CO3 __________________________。
(3)与CH3CH2OH按物质的量比1∶2反应(浓H2SO4,△)_________ __ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:选择题
下列用水就能鉴别的一组物质是
A.苯、己烷、四氯化碳 B.苯、乙醇、四氯化碳
C.硝基苯、乙醇、四氯化碳 D.硝基苯、乙醇、乙酸
查看答案和解析>>
科目:高中化学 来源:2013-2014福建龙岩市毕业联合考试理综化学试卷(解析版) 题型:填空题
(16分)辉铜矿是冶炼铜的重要原料。
(1)工业上冶炼粗铜的某种反应为:Cu2S+O2=2Cu+SO2
①当产生标况下11.2L气体时,转移电子数目为 ;
②将粗铜进行电解精炼,粗铜应与外电源的 极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,电解质溶液增重bg,则粗铜中含锌的质量分数为 ;
(2)将辉铜矿、软锰矿做如下处理,可以制得碱式碳酸铜:
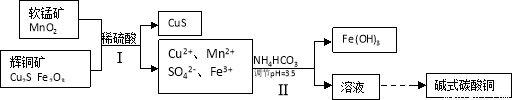
①铜单质放置于潮湿空气中,容易生成碱式碳酸铜,反应化学方程式是 ;
②步骤Ⅱ中,碳酸氢铵参与反应的离子方程式为 ;
③步骤Ⅰ中发生如下3个反应,已知反应i)中生成的硫酸铁起催化作用。请写出反应iii)的化学方程式。
i)Fe2O3+3H2SO4 =Fe2(SO4)3+3H2O
ii) Cu2S+ Fe2(SO4)3 =CuSO4+CuS+2FeSO4
iii)
④步骤Ⅱ中调节pH后的溶液中,铜离子浓度最大不能超过 mol/L。
(已知Ksp[(Cu(OH)2)]=2×10-a)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三高考模拟理综化学试卷(解析版) 题型:填空题
我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。生产流程如下:

(1)完成有关反应的化学方程式
①沉淀池: NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
②煅烧炉:
(2)联合制碱法的优点表述中,不正确的是___________
A.生产原料为:食盐、NH3、CO2
B.副产物氯化铵可做氮肥
C.生产过程中可循环利用的物质只有CO2
D.原料利用率高
某实验小组,利用下列装置模拟“联合制碱法”的第一步反应。

(3)上述装置中接口连接顺序为 ;
A.a接c;b接f、e接d B.a接d;b接f、e接c
C.b接d;a接e、f接c D.b接c;a接f、e接d
(4)D中应选用的液体为 。
为测定产品纯碱的成分和含量,做如下实验。假设产品纯碱中只含NaCl、NaHCO3杂质。
(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加 试剂。
(6)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用c mol/L的HCl溶液滴定至溶液由红色变为无色(指示CO32- +H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCl溶液总体积为V2 mL。则纯碱样品中NaHCO3质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三高考模拟理综化学试卷(解析版) 题型:选择题
下列陈述中,Ⅰ、Ⅱ都正确且两者间具有因果关系的一组是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | FeCl3溶液能腐蚀Cu | Fe的金属性强于Cu |
B | Na2O2使酚酞溶液变红 | Na2O2是碱性氧化物 |
C | Cl2可部分与水反应 | 用排饱和食盐水法收集Cl2 |
D | 浓H2SO4可干燥NO和SO2 | NO和SO2还原性都弱 |
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:填空题
(12分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a |
|
| |||||||||||||||
b |
|
|
| c | d | e | f |
| |||||||||
g | h | i | j |
| k | l | m | ||||||||||
n |
|
|
|
|
| o | p |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子外围电子排布式: 。
(2)c与a形成6个原子组成分子结构简式: ,
该分子是: (填“极性”或“非极性”)分子。
(3)表中O、P两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能 kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态P2+再失去一个电子难。对此,你的解释是 ;
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

晶胞中i原子的配位数为 ,一个晶胞中i原子的数目为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列过程需要克服分子间作用力的是( )
A.HCl气体溶于水 B.液氯汽化
C.氯化镁受热熔化 D.二氧化硅受热熔化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com