
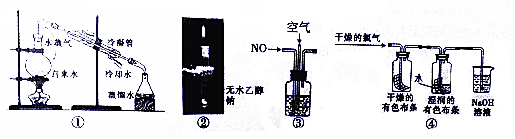
| A. | 图①用于除去自来水中的Fe3+、C1-等杂质离子 | |
| B. | 图②中直接点燃气体,证明钠与乙醇反应的气体产物是H2 | |
| C. | 图③在探究NO充分转化成HNO3的实验中,观察气泡速率控制通入气体体积比 | |
| D. | 图④用该实验可以证明Cl2体现漂白作用的原因 |
分析 A.水的沸点低,蒸馏可分离;
B.氢气不纯,加热易发生爆炸;
C.NO与氧气以4:3反应转化为硝酸;
D.干燥的布条不褪色,而湿润的布条褪色.
解答 解:A.水的沸点低,蒸馏可分离,图中蒸馏实验可除去杂质,故A正确;
B.氢气不纯,加热易发生爆炸,应检验纯度后再点燃,故B错误;
C.NO与氧气以4:3反应转化为硝酸,则观察气泡速率控制通入气体体积比,故C正确;
D.干燥的布条不褪色,而湿润的布条褪色,则图④可以证明Cl2体现漂白作用的原因,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、混合物分离提纯、物质的性质、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,能说明O元素比N元素为非金属强的是氧气与氢气化合更容易,生成的水比氨气更稳定,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+(用离子符号表示).
,能说明O元素比N元素为非金属强的是氧气与氢气化合更容易,生成的水比氨气更稳定,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+(用离子符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、N、O元素的单质与氢气化合越来越难 | |
| B. | Li、Na、K的氧化物的水化物的碱性依次减弱 | |
| C. | Na、Mg、Al的简单离子的氧化性以依次增强 | |
| D. | P、S、Cl元素的最高正价依次升高,其对应的气态氢化物的稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{16}$O2-离子的结构示意图: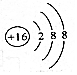 | |
| B. | 碳酸氢钠熔融时的电离方程式:NaHCO3?Na++HCO3- | |
| C. | 次氯酸的结构式:Cl-O-H | |
| D. | 过氧化氢的电子式: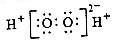 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于0.1mol/L | B. | 大于0.1mol/L | C. | 小于0.1mol/L | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗涤的目的一般是除去沉淀或晶体表面可溶性的杂质,以提高固体的纯度 | |
| B. | 洗涤的操作是:向过滤器里的固体直接注入洗涤剂浸没固体,待洗涤剂自然流下即可 | |
| C. | 洗涤的试剂根据需要一般可选用蒸馏水、冰水、乙醇或该物质的饱和溶液 | |
| D. | 是否洗净的检验:取最后一次洗涤液,鉴别含有形成相应沉淀的该溶液中的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜插入浓硝酸中:Cu+4H++2NO3?═Cu2++2NO2↑+2H2O | |
| B. | 向FeBr2溶液中通入过量氯气:2Fe2++Cl2═2Fe3++2Cl? | |
| C. | 向Al2O3中加入氨水:Al2O3+2OH?═2AlO2?+H2O | |
| D. | 碳和浓硫酸加热:C+2H++SO42?═H2O+SO2↑+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)运动会中的火炬一般采用丙烷(C3H8)为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:
(1)运动会中的火炬一般采用丙烷(C3H8)为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com