
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 3 | 0.75 | 2.25 | 3 |
| 3 | 900 | 2 | 4 | x | y | t |
分析 (1)①△G=△H-T△S<0时,反应自发进行;
②反应达到平衡状态时,同种物质的正、逆反应速率相等,平衡时各组分的物质的量、浓度、含量等不再发生变化,以及由此衍生的其它量不变,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)①根据v=$\frac{△c}{△t}$计算v(CO),再利用速率之比等于化学计量数之比计算v(CO2);
②第2组可以等效为:开始在650℃时加入1molH2O、2molCO到达平衡,保持温度不变,再加入1molCO达到平衡,最后再升高温度到900℃时到达平衡;
开始在650℃时加入1molH2O、2molCO到达平衡,与第1组为等效平衡,转化率相同,平衡时H2为0.8mol,保持温度不变,再加入1molCO达到平衡,平衡正向移动,平衡时H2物质的量大于0.8mol,升高温度到900℃时到达平衡,氢气的物质的量减小,说明升高温度平衡向逆反应方向移动;
③平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$,根据第2组实验计算平衡时各组分物质的量,反应前后气体的化学计量数不变,用物质的量代替浓度代入平衡常数表达式计算900℃平衡常数,用平衡时氢气的物质的量表示出其物质平衡时的物质的量,结合平衡常数列方程计算解答.
解答 解:(1)①该反应△H>0,△S>0,△G=△H-T△S<0时,反应自发进行,故高温下反应可以自发进行,故答案为:温度;
②a.反应前后气体的物质的量不发生变化,容器中始终压强不变,不能说明反应到达平衡,故a错误;
b.l molH-H键断裂的同时断裂2mol H-O键,断裂2mol H-O键同时生成l molH-H键,说明反应到达平衡,故b正确;
c.根据反应可知,自始至终v正(CO)=v正(H2O),若v正(CO)=v逆(H2O),则v正(H2O)=v逆(H2O),说明反应到达平衡,故c正确;
d.根据反应可知,自始至终c(CO)=c(H2),不能说明反应到达平衡,故d错误;
故选:bc;
(2)①v(CO)=$\frac{\frac{4mol-2.4mol}{2L}}{5min}$=0.16mol•(L•min)-1,速率之比等于化学计量数之,则v(CO2)=0.16mol•(L•min)-1,
故答案为:0.16mol•(L•min)-1;
②第2组可以等效为:开始在650℃时加入1molH2O、2molCO到达平衡,保持温度不变,再加入1molCO达到平衡,最后再升高温度到900℃时到达平衡;
开始在650℃时加入1molH2O、2molCO到达平衡,与第1组为等效平衡,转化率相同,平衡时H2为0.8mol,保持温度不变,再加入1molCO达到平衡,平衡正向移动,平衡时H2物质的量大于0.8mol,升高温度到900℃时到达平衡,氢气的物质的量减小,说明升高温度平衡向逆反应方向移动,故逆反应为吸热反应,
故答案为:吸热;
③平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$,
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol):1 3 0 0
转化(mol):0.75 0.75 0.75 0.75
平衡(mol):0.25 2.25 0.75 0.75
反应前后气体的化学计量数不变,用物质的量代替浓度计算平衡常数,故900℃平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.75×0.75}{0.25×2.25}$=1,
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol):2 4 0 0
转化(mol):x x x x
平衡(mol):2-x 4-x x x
故$\frac{x×x}{(2-x)×(4-x)}$=1,解得x=$\frac{4}{3}$,
故y=4-x=$\frac{8}{3}$,
故答案为:$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$;$\frac{4}{3}$;$\frac{8}{3}$.
点评 本题考查化学平衡有关计算、平衡状态判断、反应自发性等,注意掌握化学平衡常数的应用,难度中等.


科目:高中化学 来源: 题型:解答题
 .
.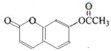 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检测时,电解质溶液中的H+向负极移动 | |
| B. | 若有 0.4 mol电子转移,则在标准状况下消耗 4.48 L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向溶液中先滴加BaCl2溶液,再滴加稀盐酸 | 滴加BaCl2后出现白色沉淀,再滴加稀盐酸沉淀不溶解 | 溶液中一定含有SO42- |
| C | 在0.1mol•L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 淀粉没有水解生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
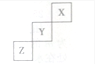
| A. | Z的最高价氧化物的水化物是强酸 | |
| B. | Y是气态氢化物稳定性小于Z的气态氢化物 | |
| C. | Z一定是活泼的金属 | |
| D. | 1molZ单质在足量的氧气中燃烧时,有6mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能自发进行的化学反应,一定是△H<0,△S>0 | |
| B. | 常温下5.0×10-3mol•L-1KHA溶液的pH=3.75,该溶液中c(A2-)<c(H2A) | |
| C. | 室温时,M(0H)2(s)?M2+(aq)+2OH-(aq) Ksp=a;c(M2+)=bmol•L-1时,溶液的pH等于14+$\frac{1}{2}$lg($\frac{b}{a}$) | |
| D. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3 | B. | NO2 | C. | Si | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
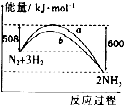
| A. | 加人催化剂后,反应过程的能量变化可用曲线b表示 | |
| B. | 生成物的总能量小于反应物的总能量 | |
| C. | 热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1 | |
| D. | 在298 K、恒容密闭容器中,通人1 mol N2和3 mol H,充分反应后放出的热量为92kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4mL 2mol/L NH4Cl 溶液 | 沉淀溶解 |
| Ⅱ | 4mL蒸馏水 | 沉淀不溶解 |
| 序号 | 实验内容 | 结 果 |
| 1 | 测定醋酸铵溶液的pH | pH约为7,溶液呈中性 |
| 2 | 取少量的相同质量的氢氧化镁分别盛放在试管中,分别向其中滴加醋酸铵溶液和氯化铵溶液 | 固体均溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com