
将4g NaOH固体溶解在水里,配得1L溶液,溶液的物质的量浓度是
A.10 mol/L B.1mol/L C.0.1 mol/L D.0.01 mol/L
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
| A、②④⑤ | B、①③⑥ | C、①③④ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省原名校高三高考仿真模拟统一考试理综化学试卷(解析版) 题型:填空题
(14分)氧化锌是橡胶、油漆、搪瓷、电缆、医药、电子、化学等工业的重要原料。以氧
化锌粗品为原料制备活性氧化锌的生产工艺流程如下:
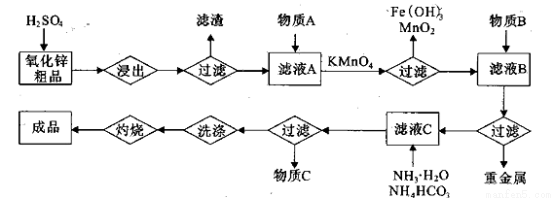
(1).浸出”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+、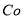 +、Mn2+等
+、Mn2+等
杂质。物质A的作用是调节溶液的pH至5 4,物质A最好选择________。
A.NH3.H2O B.Na2CO3 C. H2SO4 D.ZnO
已知25℃时部分金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH如下表:

该温度下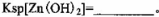 。
。
(2) KMnO4的作用是除去Mn2+和Fe2+,则KMnO4与Mn2+反应的离子方程式为_____________________________________;若溶液中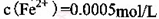 ,则处理1
,则处理1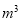 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
(3)杂质Cu2+、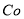 2+可利用置换反应除去,则物质B是_________。
2+可利用置换反应除去,则物质B是_________。
(4)被灼烧的沉淀是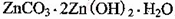 ,生成该沉淀的化学方程式为________。
,生成该沉淀的化学方程式为________。
如何检验该沉淀是否洗净?________________________________。
查看答案和解析>>
科目:高中化学 来源:2014秋季江西省赣州市十二县高一上学期期中联考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42—+Ba2++2OH-=BaSO4↓+2H2O
C.氧化铜与稀硫酸反应:2H++O2-=H2O
D.碳酸氢钠溶液中加入盐酸:CO32—+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源:2014秋北京市高一上学期期中化学试卷(解析版) 题型:填空题
(7分)某氯化钠样品中混有碘化钠。为获得纯净的氯化钠固体,设计了如下图所示的实验流程:
【查阅资料】氯的单质可以置换出碘化物中的碘。
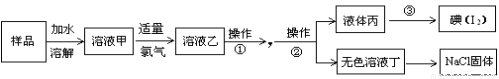
阅读上述实验流程,完成下列填空:
(1)写出溶液甲与氯水发生反应的离子方程式 。
(2)从“无色溶液丁”中获取氯化钠固体必要的实验操作是:___________(填序号)。
A.蒸馏 B.蒸发结晶 C.冷却结晶
(3)操作①的名称 ;所需要的主要试剂是 。
(4)操作②的名称 ;从液体丙获得碘的方法是 。
查看答案和解析>>
科目:高中化学 来源:2014秋北京市高一上学期期中化学试卷(解析版) 题型:选择题
将0.5L 1mol/L FeCl3溶液加水稀释至1L,所得溶液中氯离子的物质的量浓度是
A.3mol/L B.2mol/L C.1.5mol/L D.1mol/L
查看答案和解析>>
科目:高中化学 来源:2014秋北京市高一上学期期中化学试卷(解析版) 题型:选择题
下列反应既是离子反应又是氧化还原反应的是
A.BaCl2溶液滴入稀硫酸中
B.盐酸滴在生石灰上
C.铁粉撒入CuSO4溶液中
D.向炽热氧化铁通入CO
查看答案和解析>>
科目:高中化学 来源:2014秋北京市高一上学期期中化学试卷(解析版) 题型:选择题
下列生产和生活中的事实与氧化还原反应无关的是
A.冶炼金属 B.燃料燃烧 C.钢铁锈蚀 D.木材烘干
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江苏省高二(文)上学期期中化学试卷(解析版) 题型:实验题
(10分)某化学小组欲以CO2主要为原料,采用下图所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究。请你参与并完成对有关问题的解答。
【资料获悉】
1、“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,然后再将NaHCO3制成Na2CO3。
2、Na2CO3与盐酸反应是分步进行:Na2CO3先与盐酸反应生成NaHCO3;然后再发生NaHCO3+HCl= NaCl+H2O +CO2↑
【实验设计】
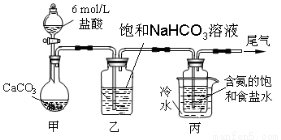
【实验探究】
(1)装置乙的作用是 。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有 、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为 。
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如下图所示。
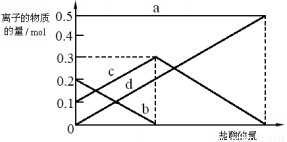
则曲线c对应的溶液中的离子是 (填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是 。
(4)若将装置甲产生的纯净的CO22.24L(标准状况下)通入100mLNaOH溶液中,充分反应后,将溶液小心蒸干,得到不含结晶水的固体W,其质量为10.16g,则W的成分为 (填化学式),原NaOH溶液的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com