
【题目】铜及其化合物在生产、生活中有广泛的应用。某研究性学习小组的同学对铜常见化合物的性 质和制备进行实验探究,研究的问题和过程如下:
I.探究不同价态铜的稳定性,进行如下实验:
(1)向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子方程式为:______。由此可知,在酸性溶液中,+2价Cu比+1价Cu更______(填“稳定”或“不稳定”)。
(2)将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该反应说明:在高温条件下,+1价的Cu比+2价Cu更________(填“稳定”或“不稳定”)。
II.制取硫酸铜(装置如图1)
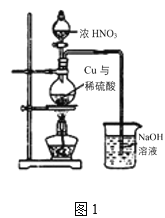
(3)烧瓶内发生的主要反应的化学方程式为______(已知烧杯中反应:2NaOH+2NO2=NaNO3+NaNO2+H2O)
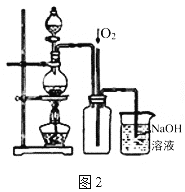
(4)图2是图1的改进装置,其中直玻璃管通入氧气的作用是________。
Ⅲ.探究用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl22H2O)。
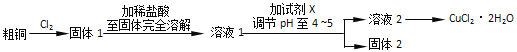
(5)实验室采用如图所示的装置,可将粗铜与Cl2反应转化为固体l(部分仪器和夹持装置已略去),有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要______(填“是”或“否”),试剂x为______。

(6)将溶液2转化为CuCl22H2O的操作过程中,发现溶液颜色由蓝色变为绿色。已知:在氯化铜溶液中有如下转化关系:[Cu(H2O)4]2+(aq,蓝色)+4Cl-(aq)![]() CuCl42-(aq,黄色)+4H2O(l),该小组同学取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是______(填序号)(已知:较高浓度的CuCl42-溶液呈绿色)。
CuCl42-(aq,黄色)+4H2O(l),该小组同学取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是______(填序号)(已知:较高浓度的CuCl42-溶液呈绿色)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
(7)若制得的CuCl22H2O晶体仍然含有较多杂质,则可采用_______(填方法名称)进行提纯。
【答案】Cu2O+2H+=Cu2++Cu+2H2O 稳定 稳定 Cu+H2SO4+2HNO3(浓)=CuSO4+2NO2↑+2H2O、3Cu+3H2SO4+2HNO3(稀)=3CuSO4+2NO↑+4H2O 氧气氧化氮氧化合物,使氮氧化物全部被氢氧化钠溶液吸收,防止污染大气 否 CuO abc 重结晶
【解析】
I.该实验的目的是探究不同价态铜的稳定性,则根据题干给出的提示分析即可;
II.该实验目的是制取硫酸铜,则反应中,HNO3只作氧化剂,H2SO4则起酸性作用,可写出该反应的方程式,需要注意的是随着反应的进行,HNO3的浓度降低,还原产物也会随之变化;
III.该实验的目的是制备氯化铜晶体,该实验的流程中:第一步,粗铜和氯气反应是为了生成CuCl2,少量的杂质Fe会转化为FeCl3;第二步,用盐酸溶解固体1,是为了使得固体全部出于强酸性环境中,方便后续分离;第三步,要加入CuO来调节溶液的pH,把Fe3+转化为Fe(OH)3,从而除去杂质;第四步,在HCl氛围中蒸发溶液2的到目标产物;
(5)不需要除去HCl气体,因为反应后,还需要用稀盐酸将固体全部溶解;所得溶液1中含有HCl、FeCl3,需要加入CuO来调节溶液pH,使Fe3+全部转化为沉淀,而Cu2+仍存在于溶液中;固体2是Fe(OH)3;
(6)题中已经告知这种转化关系是可逆反应,利用平衡移动的知识答题;
(7)提纯晶体,往往采用重结晶。
I.该实验的目的是探究不同价态铜的稳定性,则:
(1)Cu2O遇到酸反应生成蓝色的Cu2+盐溶液和单质Cu,则在酸性环境中,+2价的Cu比+1价的Cu稳定;
(2)高温下,CuO分解产生Cu2O,则+1价的铜比+2价的Cu稳定;
II.该实验目的是制取硫酸铜,则:
(3)发生的反应为Cu+H2SO4+2HNO3(浓)=CuSO4+2NO2↑+2H2O、3Cu+3H2SO4+2HNO3(稀)=3CuSO4+2NO↑+4H2O;
(4)产物中NO不能单独和NaOH反应,需要用O2将NO氧化为NO2才行,确保尾气完全被吸收,以防污染环境;
III.该实验的目的是制备氯化铜晶体,则:
(5)不需要除去HCl气体,因为反应后,还需要用稀盐酸将固体全部溶解;所得溶液1中含有HCl、FeCl3,需要加入CuO来调节溶液pH,使Fe3+全部转化为沉淀;
(6)题中已经告知这种转化关系是可逆反应,则
a、将Y稀释,则H2O的量增多,平衡向逆反应方向移动,溶液变为蓝色,说明溶液中有这样的转化关系,a正确;
b、向Y中加入CuCl2晶体,则溶液中[Cu(H2O)4]2+、Cl-的浓度均增大,平衡向正反应方向移动,CuCl42-的浓度增大,溶液变为绿色,说明溶液中有这样的转化关系,b正确;
c、向Y中加入NaCl晶体,则溶液中Cl-的浓度均增大,平衡向正反应方向移动,CuCl42-的浓度增大,溶液变为绿色,说明溶液中有这样的转化关系,c正确;
d、取Y进行电解,溶液颜色消失,这个过程和该转化关系无关,d错误;
故选abc;
(7)提纯晶体,往往采用重结晶。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】常温下,分别向体积相同、浓度均为1 mol/L的HA、HB两种酸溶液中不断加水稀释,酸溶液的pH与酸溶液浓度的对数(lg C)间的关系如图。下列对该过程相关分析正确的是

A. HB的电离常数(KA)数量级为10-3
B. 其钠盐的水解常数(Kh)大小关系是:NaB>NaA
C. a、b两点溶液中,水的电离程度b<a
D. 当lg C= -7时,两种酸溶液均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.常温下,0.1 mol·L-1的碳酸钠溶液中含有的阴离子数大于0.1NA
B.氢原子数为0.4NA的甲醇分子中含有的共价键数为0.4NA
C.6.4gS6与S8的混合物中所含S原子数一定为0.2NA
D.标准状况下,2.24LCl2与过量NaOH溶液反应转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 A 经李比希法和质谱法分析得知其相对分子质量为 136,分子式为 C8H8O2,A 的核磁共振氢谱如图:

峰面积之比为 1:2:2:3,A 分子中只含一个苯环,且苯环上只有一个取代基,其红外光谱如图:

则 A 的结构简式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为几种晶体或晶胞的示意图:

请回答下列问题:
(1)a:冰、b:金刚石、c:MgO、d:CaCl2、e:干冰 5 种晶体的熔点由高到低的顺序为________
(2)金刚石晶胞中若碳原子半径为 r,根据硬球接触模型,列式表示碳原子在晶胞中的空间占有率________(计算结果为含 π 的分数,不要化为小数或百分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应 aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则( )
A. 平衡向正反应方向移动了 B. 平衡向逆反应方向移动了
C. 物质B的质量分数减小了 D. a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验原理和装置能达到实验目的的是

A.装置甲:制取银氨溶液B.装置乙:除去乙烯中混有的SO2
C.装置丙:制取乙烯D.装置丁:验证溴乙烷在氢氧化钠醇溶液加热条件下发生了消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列有关仪器的使用,能实现的是_______________(填序号)
A.用托盘天平称取11.70g食盐
B.用量筒量取12.36mL盐酸
C.用酸式滴定管量取21.20mL 0.10mol/L H2SO4溶液
D.用200mL容量瓶配制500mL 0.1mol/L NaCl溶液
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
(2)下图是酸式滴定管中液面在滴定前后的读数:则C (NaOH) = ______________。

(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏______。
III. 我们知道空气中含有N2、O2、CO2、H2S等气体。试判断下列滴定操作的终点、分析下列现象的原因,并写出有关离子方程式。
(1)以酚酞为指示剂,用碱液滴定酸液到___________________________为终点。约半分钟后导致褪色的原因:________________________________________________。
(2)以淀粉为指示剂,用Na2S2O3滴定I2(2S2O32-+I2=S4O62-+2I-)到 __________________为终点,约5min后溶液又显色的原因: _________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的晶胞结构示意图如图所示,它的化学式是
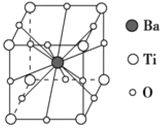
A. BaTi8O12
B. BaTiO3
C. BaTi2O4
D. BaTi4O6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com